1 引言(Introduction)
微生物氣溶膠在自然環境中普遍存在(Després et al., 2012;房文艷等, 2015;方治國等, 2005).通常, 微生物氣溶膠含有細菌和真菌等微生物粒子, 按其種類被分為細菌氣溶膠和真菌氣溶膠.細菌氣溶膠粒徑范圍為0.5~100 μm, 芽孢桿菌(Bacillus)、假單胞菌(Pseudomonas)、鞘氨醇單胞菌屬(Sphingomonas)、葡萄球菌(Staphylococcus)等為常見的細菌種類(于璽華, 2002).有研究證實, 污水處理過程有微生物氣溶膠的產生和逸散(劉建偉等, 2013;Han et al., 2013;Brandi et al., 2000;Li et al., 2013).由于污水及其處理設施中的微生物以細菌為主, 因此, 污水處理廠微生物氣溶膠的研究對細菌群落結構更為關注, 特別是污水中存在病原菌和潛在致病細菌.因此, 要解析污水處理廠微生物氣溶膠中細菌群落多樣性, 選擇適宜的采樣和分析方法是關鍵.
根據采樣器的原理, 微生物氣溶膠采樣方法分為自然沉降法、射流撞擊式采樣法、離心式采樣法、過濾式采樣法和靜電沉降式采樣法(于璽華, 2002;李濤, 2003).其中, 固體多級撞擊式的Andersen采樣器具有操作簡便、采樣效率高、微生物存活率高等優點, 通常作為可培養微生物氣溶膠采集的標準方法被廣泛應用(Xu et al., 2013).此外, 過濾式采樣法具有抽氣設備流量大、收集效率高等優點, 其中, 大流量的總懸浮顆粒物采樣器常應用于基于非培養法的微生物氣溶膠分子生物學研究(Cao et al., 2014).在分析方法方面, 傳統的培養法在研究微生物氣溶膠的微生物多樣性方面存在局限性, 只能檢測可培養微生物, 其數量不到微生物總數的10%(Dong et al., 2016;Urbano et al., 2011).近年來, 隨著現代分子生物學技術的快速發展, 空氣微生物群落的解析方法也從培養法向非培養法發展(方治國等, 2016).16S rDNA克隆文庫技術(Urbano et al., 2011;Han et al., 2012)、聚合酶鏈式反應-變性凝膠梯度電泳(Polymerase chain reaction- denatured gradient gel electrophoresis, PCR-DGGE)(Xu et al., 2013)、基因芯片技術(Peccia et al., 2006;方治國等, 2016)、末端限制性酶切片段長度多態性分析(Terminal restriction fragment length polymorphism, T-RFLP)(方治國等, 2016)、熒光原位雜交技術(Fluorescence in situ hybridization, FISH)(Lange et al., 1997)、定量PCR技術(Wery et al., 2008;Yamamoto et al., 2014)和空氣微生物宏基因組學(Cao et al., 2014;Yamamoto et al., 2014;Dannemiller et al., 2014)等技術在環境細菌氣溶膠和真菌氣溶膠的群落組成鑒定、豐度的確定、對特異性的致病細菌或病毒的定量檢測中已有應用.此外, 指紋圖譜技術、核酸雜交技術及高通量測序技術可以直接在分子水平上全面分析復雜環境微生物群落結構及多樣性(Cao et al., 2014;Kumaraswamy et al., 2014).但如何解析污水處理廠細菌氣溶膠目前尚沒有標準方法.
本研究以某城市污水處理廠為研究對象, 以收集氣溶膠中全部細菌效率最高的總懸浮顆粒物采樣器進行樣品收集, 并利用高通量測序技術對樣品中全部細菌的多樣性與群落結構進行分析.作為對照, 同步采用收集氣溶膠中可培養細菌效率最高、應用最廣泛的Andersen六級采樣器采樣, 用克隆文庫技術進行分析, 以對比高通量測序與傳統的培養法對同一采樣點細菌氣溶膠解析的異同, 為確定適宜污水處理廠細菌氣溶膠的分析方法提供科學依據.
2 材料與方法(Materials and methods)2.1 采樣點
細菌氣溶膠樣品采自某城市污水處理廠, 該污水處理廠采用SBR工藝處理生活污水, 規模為5.0×104 m3·d-1.細菌氣溶膠采樣點沿污水處理工藝布置, 包括細格柵、粗格柵、沉砂池、SBR池和污泥脫水間.另外, 選取污水處理廠外的上風向200 m和下風向200 m處作為對照點.采樣高度設置距地面1.5 m處(人呼吸高度).
2.2 采樣方法
總懸浮顆粒物采樣器:采用智能中流量便攜式總懸浮顆粒物采樣器(TH-150C, 武漢天虹儀表有限責任公司), 采樣膜為直徑90 mm的石英濾膜(PALL, NY, U.S.), 其對顆粒物的截留率為99.9%, 采樣流量為100 L·min-1, 采樣時間不低于4 h.不同采樣點的細菌氣溶膠樣品同步采集.采樣完畢, 用無菌鑷子取出采樣膜, 保存在無菌錫箔紙內, 盡快轉運到實驗室立即處理, 或者凍存于-80 ℃冰箱內.
Andersen采樣器:采用Andersen六級固體撞擊式采樣器(228-9530 K, SKC Gulf Coast Inc., USA), 由六級帶有微小噴孔的鋁合金圓盤撞擊器組成, 每級撞擊器有400個孔, 孔的直徑逐漸縮小, 模擬人體呼吸道的解剖結構和空氣動力學特征, 采用慣性撞擊原理將空氣中懸浮的微生物粒子按照粒徑大小分等級地收集到采樣載體表面, 圓盤下方放盛有采樣介質的培養皿, 本研究選取直徑為90 mm的營養瓊脂平板(02-275, 北京奧博興生物技術有限責任公司)作為細菌氣溶膠分級截留介質, 設置抽氣速率為28.3 L·min-1, 樣品采集時間為3 min, 采集過程中設置3個平行.
2.3 分析方法2.3.1 DNA提取
總懸浮顆粒物中全細菌DNA提取:在無菌條件下, 將總懸浮顆粒物采樣器收集在石英濾膜上的顆粒物樣品剪碎, 用40 mL無菌1×PBS緩沖液洗脫顆粒物, 置于4 ℃低溫低速離心機中, 200 g離心2 h.通過真空過濾裝置, 將上述離心后的緩沖液濃縮顆粒物至聚醚砜濾膜(PES)上, 剪碎此濾膜立即加入到MO-BIO PowerSoil DNA試劑盒(Carlsbad, CA, U.S.)中的PowerBead Tube中, 按參考文獻報道的優化提取方法提取DNA(Jiang et al., 2015).
可培養細菌DNA提取:通過Andersen采樣器收集細菌培養基上的顆粒物, 30 ℃恒溫培養48 h后, 使用1×PBS緩沖液收集所有細菌培養物, 采用核酸自動提取儀(TanBead, 臺灣)對細菌總DNA進行提取.
2.3.2 總懸浮顆粒物樣品的高通量測序與數據統計分析
總懸浮顆粒物中全部細菌的DNA測序所用擴增引物為V3+V4區338F/806R(5′-ACTCCTACGGGAGGCAGCA-3′/5′GGACTACHVGGG TWTCTAAT-3);PCR擴增程序如下:95 ℃預變性3 min;95 ℃變性30 s, 55 ℃退火30 s, 72 ℃延伸45 s, 27個循環;72 ℃延伸10 min;最后保持在10 ℃直到取出樣品.擴增產物采用2.0%瓊脂糖凝膠電泳檢測, 使用AxyPrep DNA凝膠抽提試劑盒(AXYGEN)對PCR產物切膠純化回收.
DNA序列通過Illumina Miseq平臺進行測序, 按照97%相似性對非重復序列(不含單序列)進行操作分類單元OTU(operational taxonomic units)聚類, 在聚類過程中去除嵌合體, 得到OTU的代表序列.為了得到每個OTU對應的物種分類信息, 采用Ribosomal Database Project(RDP) Classifier貝葉斯算法對97%相似水平的OTU代表序列進行分類學分析, 并分別在門(phylum)、綱(class)、目(order)、科(family)、屬(genus)不同分類水平下統計各樣本的群落組成.
2.3.3 可培養細菌克隆文庫的構建與多樣性分析
可培養細菌DNA產物經過PCR擴增后構建克隆文庫, 所用引物及擴增程序、覆蓋度和多樣性的計算參考本課題組前期報道(Han et al., 2013), 其中, 覆蓋度C的計算方法如式(1)所示, C值≥75%方可認為挑取的克隆數足以反映真實的群落結構, C值越高, 表明挑取的克隆對真實群落的覆蓋程度越高.
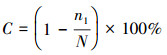
(1)
式中, N為16S rDNA克隆文庫的庫容, 即挑取的陽性克隆總數目;n1為16S rDNA克隆文庫中僅出現一次的克隆.
多樣性以Shannon-Wiener指數進行評估, 計算方法如式(2)所示:
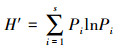
(2)
式中, Pi為第i個OTU在克隆文庫庫容中所占的比例, 本研究中在相似度≥97%分類水平下劃分OTU, OTU越多表明鑒定的細菌種類越多;S為克隆文庫中OTU的總數目.
3 結果與分析(Results and analysis)3.1 細菌氣溶膠豐富度和多樣性分析
分別對污水廠不同采樣點樣品的克隆文庫和高通量測序的結果進行統計, 結果見圖 1.通過克隆文庫挑取的陽性克隆數范圍為43~107個, 劃分的OTUs個數為11~37個;高通量測序技術獲得的序列數范圍為23656~42383個, 劃分的OTUs個數為1212~1638個.基于克隆文庫技術用某一陽性克隆的序列來代表某一物種、高通量測序技術用某一序列代表某一物種的原理, 顯而易見, 各采樣點用“總懸浮顆粒物采樣器+高通量測序技術”檢測出的物種數量均遠多于用“Andersen六級采樣器+克隆文庫技術”檢測出的物種數量, 表明高通量測序技術對于細菌氣溶膠群落結構豐富度的表征具有優勢.
圖 1
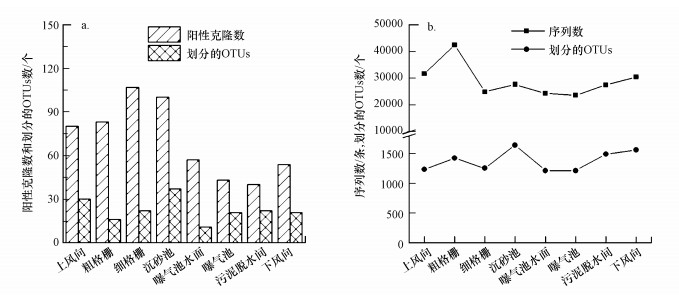
圖 1 16S rDNA克隆文庫(a)和高通量測序技術(b)分析細菌氣溶膠獲取的測序信息
進一步對上述測序結果做細菌群落組成覆蓋度的評價, 結果如圖 2所示.克隆文庫技術對污水處理廠不同采樣點氣溶膠中細菌的覆蓋度范圍為77.50%~90.40%, 不同采樣點氣溶膠中細菌群落結構的覆蓋度差別較大;而高通量測序對所有細菌氣溶膠的覆蓋度均大于99%.上述結果表明, 盡管克隆文庫技術和高通量測序技術在呈現氣溶膠中細菌群落結構覆蓋度方面均達到了實驗理論的標準要求, 但高通量測序技術在呈現群落結構覆蓋度的穩定性和全面性方面顯著優于克隆文庫技術.
圖 2
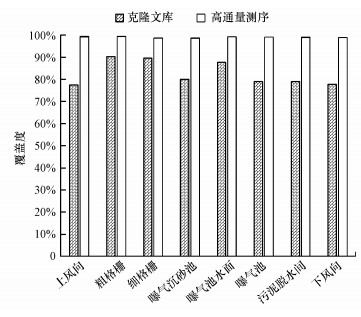
圖 2通過16S rDNA克隆文庫和高通量測序技術分析細菌氣溶膠群落結構的覆蓋度
對各采樣點氣溶膠樣品中的細菌多樣性(屬分類水平)進行分析, 結果見圖 3.依據式(2)計算的氣溶膠中的細菌Shannon-Wiener指數表明, 克隆文庫分析可培養細菌的多樣性指數為0.58(粗格柵)~2.37(污泥脫水間), 而通過高通量測序對全部細菌多樣性指數的分析結果為5.06(細格柵)~5.99(污泥脫水間).高通量測序技術檢測到的各采樣點氣溶膠中的細菌多樣性均遠高于克隆文庫檢測到的結果.具體聯系污水寶或參見http://www.jianfeilema.cn更多相關技術文檔。
圖 3
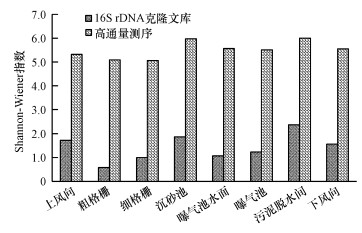
圖 3通過16S rDNA克隆文庫和高通量測序技術分析細菌氣溶膠的Shannon-Wiener指數
3.2 細菌氣溶膠群落結構的解析
在門、綱、目、科和屬5種分類水平下, 分別對污水處理廠各采樣點的細菌氣溶膠克隆文庫和高通量測序的結果進行統計(表 1), 結果表明, 無論在何種分類水平下, 高通量測序對于氣溶膠中的細菌群落組成的解析更全面.
表 1 克隆文庫和高通量測序對細菌氣溶膠在不同分類水平的對比
圖 4展示的是在門分類水平下, “總懸浮顆粒物采樣器+高通量測序技術”和“Andersen六級采樣器+克隆文庫技術”對細菌氣溶膠群落組成的解析結果.在所有采樣點的細菌氣溶膠中, 克隆文庫僅檢測到厚壁菌門(Firmicutes)、變形菌門(Proteobacteria)和放線菌門(Actinobacteria)3種細菌門類, 其中前兩者為主要的細菌門類(圖 4a), 同時, 這兩種菌門在不同采樣點的分布差別較大, 例如, 厚壁菌門在粗格柵(90.0%)、細格柵(92.2%)和沉砂池(78.9%)的占比較高, 而變形菌門在曝氣池水面(62.1%)和污泥脫水間(74.4%)為優勢菌門.
圖 4
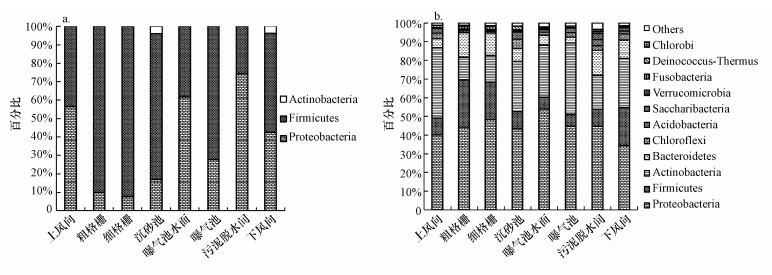
圖 4通過16S rDNA克隆文庫(a)和高通量測序技術(b)分析細菌氣溶膠在門類水平的群落結構
高通量測序獲得的細菌門類共有34個(表 1), 其中, 豐度≥1%的有11個, 其100%地覆蓋了克隆文庫測得的3種優勢菌門.除此之外, 還特異地鑒定到包括擬桿菌門(Bacteroidetes, 3.06%~13.48%)等在內的其他優勢菌門, 總比例為72.1%~91.7%(圖 4b).
上述結果表明, 在門分類水平下, 克隆文庫技術由于測序通量低和挑取陽性克隆的隨機性等弊端(張玉等, 2018), 重復檢出厚壁菌門和變形菌門細菌, 高估了其在污水廠細菌氣溶膠中的占比, 而低估甚至忽略了包括擬桿菌門、綠彎菌門(Chloroflexi)、酸桿菌門(Acidobacteria)等在內的其他細菌門類的分布比例(圖 4b).高通量測序可一次并行對幾十萬到幾百萬條DNA分子進行序列測定, 克服了克隆文庫測序的上述弊端, 可以更全面、客觀地對微生物群落多樣性進行評估.
在屬分類水平下, 利用克隆文庫分析技術檢測氣溶膠中的細菌群落組成如圖 5所示, 在鑒定到的31個細菌菌屬中(豐度均大于1%), 各個采樣點的群落組成差別較大, 例如, 芽孢桿菌屬(Bacillus)為所有采樣點的優勢菌屬, 其中, 在粗格柵和細格柵的細菌氣溶膠群落組成中占絕對優勢, 分別占87.0%和74.8%, 而在曝氣池水面和污泥脫水間的比例分別為6.90%和15.0%;氣單胞菌屬(Aeromonas)為曝氣池水面處的優勢菌屬(55.2%).導致不同采樣點氣溶膠中細菌群落結構差異的原因一方面是由于上述克隆文庫的技術弊端;另一方面與污水廠不同處理工段的構筑物特點、污水處理設施等有關, 例如, 本研究選取的這座污水廠的粗格柵和細格柵為室內操作間, 其中, 粗格柵為地下7 m左右的操作間, 粗格柵和細格柵均不加蓋, 湍急的進水將污水中大量的微生物釋放到空氣中形成氣溶膠, 在具有穩定氣象條件的室內環境中不斷累積, 導致其群落組成與設置于室外曝氣池處的氣溶膠中的細菌群落組成明顯不同.
圖 5
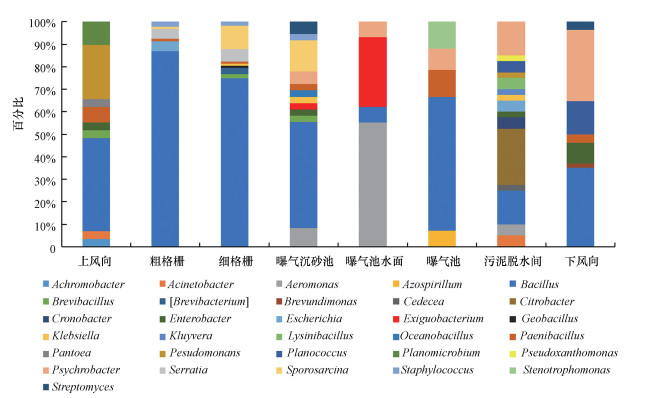
圖 5通過16S rDNA克隆文庫技術分析細菌氣溶膠在屬分類水平的群落結構
高通量測序技術共檢測到422個細菌菌屬(表 1), 其中豐度≥1%的共有79個(豐度小于1%的全部歸類為Others)(圖 6).兩種測序技術共同鑒定到6個菌屬, 高通量測序技術特異地檢測到的細菌菌屬占83.3%~98.5%, 其對于群落多樣性的解析顯著優于克隆文庫技術.
圖 6
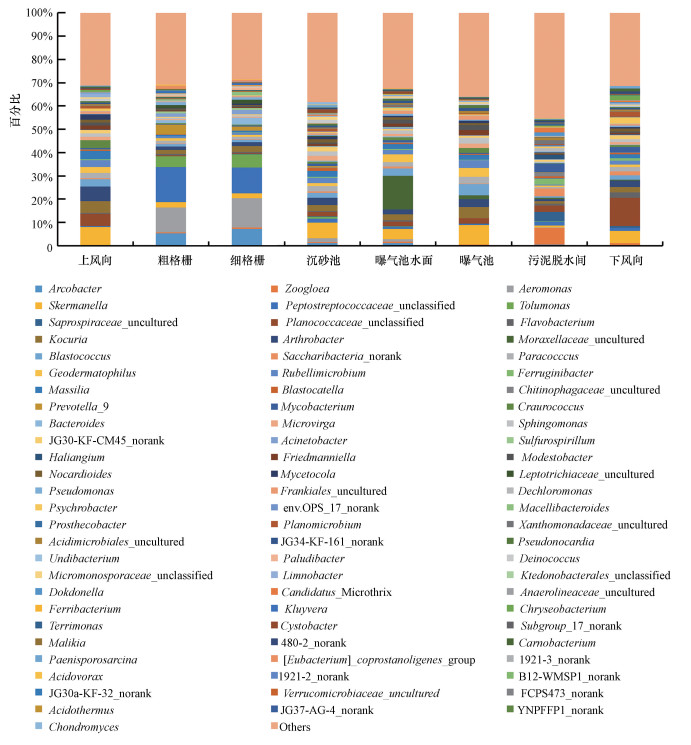
圖 6高通量測序技術分析細菌氣溶膠在屬分類水平的群落結構
值得一提的是, “總懸浮顆粒物采樣器+高通量測序技術”和“Andersen六級采樣器+克隆文庫技術”對同一采樣點細菌氣溶膠的全部細菌和可培養細菌的優勢群落鑒定結果幾乎完全不同, 而高通量測序對全部細菌群落結構的解析更能證明污水廠不同采樣點細菌氣溶膠與其逸散源的關系, 例如, 在進水段的粗格柵和細格柵處的優勢菌屬為氣單胞菌屬(10.7%、12.5%)和消化鏈球菌屬(Peptostreptococcaceae_unclassified)(15.1%、11.1%), 前者普遍存在于淡水、淤泥和污水等環境中(Parker et al., 2011), 而后者常見于人和動物的口腔、腸道和呼吸道, 在人類女性泌尿生殖道也是正常的生理菌群, 污水廠的進水作為收納這類微生物的水體(Lu et al., 2015;Jiang et al., 2015), 進水過程中的跌水等環節會將其釋放到周圍的環境中(Brandi et al., 2000;Li et al., 2013);而污泥脫水間氣溶膠中7.1%的細菌隸屬于細菌菌膠團(Zoogloea), Zoogloea為活性污泥的主體, 而本研究中污泥脫水間內的污泥脫水機為離心式且為不加蓋的設備, 在脫水過程中會將活性污泥中的細菌直接釋放到周圍空氣中.
上述結果表明, 細菌氣溶膠直接提取DNA并通過高通量測序對細菌氣溶膠優勢菌的解析, 更能說明細菌氣溶膠與其釋放源的關聯性, 可更全面、真實地反映細菌氣溶膠的群落分布狀態, 近幾年高通量測序技術的快速發展, 為空氣微生物的宏基因組解析提供了操作簡便、通量大、信息全面、經濟適用的技術支持(Behzad et al., 2015), 但該分析方法由于讀長較短, 對于準確鑒定細菌的種類存在一定缺陷.而通過傳統的可培養法結合克隆文庫收集并解析細菌氣溶膠, 實際是選擇性地收集易于培養細菌的過程, 因而導致其分析結果具有較強的隨機性和較大偏差, 此外, 該法操作繁復, 大批量、復雜空氣微生物的解析需大量的人力和高昂的費用, 獲取的序列通量有限, 盡管如此, 16S rDNA克隆文庫作為一項成熟的測序技術, 可操作性強, 獲得的測序片段較長(大約為1500 bp), 可以準確地確定微生物的分類, 對微生物多樣性較低樣本的準確鑒定依然適用.
4 結論(Conclusions)
通過總懸浮顆粒物采樣器收集污水處理全過程中的細菌氣溶膠, 并通過高通量測序技術對其進行序列測定, 結果表明, 相對于對照組采用Andersen采樣器的傳統可培養方法和克隆文庫分析方法, 前者特異地檢測到細菌氣溶膠中83.3%~98.5%的細菌菌屬, 氣溶膠中的多個細菌優勢菌屬在污水、污泥中廣泛存在, 因此, 采用“總懸浮顆粒物采樣器+高通量測序技術”在解析污水處理廠氣溶膠中細菌多樣性、群落結構覆蓋度、穩定性和全面性方面具有明顯的優勢, 能客觀說明細菌氣溶膠與其釋放源的關聯性, 全面和真實地反映細菌氣溶膠的群落分布狀態.但該分析方法由于讀長較短, 對于準確鑒定細菌的種類尚存在一定缺陷.(來源:環境科學學報 作者:許光素)



