高含固[進料含固率(total solids,TS)>10%]厭氧消化是解決我國脫水污泥處理處置問題的重要途徑.相比傳統的低含固厭氧消化(含固率為1%~5%)[1],高含固厭氧消化技術甚至可以直接利用污水處理廠的脫水污泥(含固率為20%),因而具有設施體積小、水耗及能耗較低等優勢.另外,高含固厭氧消化系統和傳統的低含固厭氧消化系統相比,VS降解率基本相當,而高含固厭氧消化系統的單位容積產氣率更高[2],具有更好的應用前景.
然而,由于污泥高含固厭氧消化系統的進料中含氮物質如蛋白質、尿素等含量更高,經過微生物的作用,它們會最終降解為小分子的氨氮并累積在系統中.過高的氨氮濃度會對微生物產生毒害作用[3],從而降低整個消化系統的產氣性能.總氨氮(TAN)又分為銨根離子和游離態的氨(FAN),其中游離氨具有較高的細胞膜滲透性而被認為是產生氨抑制的主要原因[4].微生物被氨氮抑制的可能機制是游離氨作為疏水性分子,通過被動擴散作用進入細胞,破壞了細胞內外質子平衡并導致鉀的缺乏[5].另外,進入細胞的游離氨在細胞內轉變為銨,銨在細胞內積累改變了細胞內的pH,從而對細胞產生毒害作用[6].關于游離氨對厭氧消化系統的影響,由于系統的含固率、基質、溫度和接種泥馴化程度等各種因素的不同,所得出的游離氨抑制閾值也從幾十到幾百毫克升不等[7].例如,傳統的低含固厭氧消化系統中,FAN在145 mg·L-1,pH為7.43時便會使家禽糞便懸浮液厭氧消化的產氣量下降27%[8].在高含固厭氧消化系統中,Hidaka等[9]的實驗發現FAN在不到600 mg·L-1的條件下,高含固系統COD降解率就受到明顯抑制.然而,微生物對于游離氨的耐受度可以更高,Kim等[10]發現FAN為700 mg·L-1時系統仍能穩定運行不受抑制.而Calli等[11]利用人工配水作為基質,在提高游離氨的過程中,COD降解率一直維持在78%~96%,即使在FAN最終達到800 mg·L-1時依然維持在80%,系統性能并沒有受到抑制.所以,厭氧消化氨抑制研究的重點不僅在于獲得游離氨的抑制閾值濃度,還在于研究游離氨濃度改變背后相關的微生物種群結構和代謝途徑的變化,從而真正揭示氨抑制的機制.游離氨的計算方法與總氨氮、pH和溫度有關,在溫度不變的情況下,環境中的pH值越低,FAN也越低.例如在厭氧消化溫度為37℃的條件下,當pH從8.0降低至7.0時,FAN占TAN的比例將會從11%下降至1.2%,因而降低pH是一種降低系統中FAN濃度的方法.不同的微生物的適宜pH范圍也有所不同, 產甲烷菌的最適宜pH范圍為6.5~7.8[12],而產酸菌最佳pH在5.5~7.0[3],控制pH在微生物適宜的范圍內可能可以減輕FAN的抑制作用[9].
本實驗采用9 L的半連續厭氧消化裝置,以脫水污泥為原料,分別通過降低pH和人為投加氨氮的手段來降低和提高反應器內的游離氨濃度,以考察兩種調控手段下游離氨濃度的變化對厭氧消化系統性能的影響.與此同時,利用高通量測序和定量PCR的分析方法,研究高含固污泥厭氧消化系統在不同的游離氨調控策略下性能參數以及相應的細菌和古菌種群結構和數量的變化,以期為最終合理控制高含固厭氧消化體系中游離氨濃度,保證消化系統良好穩定地運行提供理論支撐.
1 材料與方法
1.1 厭氧消化實驗
實驗中的脫水污泥取自上海某污水處理廠的脫水污泥機房,脫水后的污泥含固率(TS)和揮發性固體(VS)占總固體比例(VS/TS)分別為20.1%和53.9%.實驗所用接種污泥取自實驗室中穩定運行的脫水污泥中溫厭氧消化反應器,TS和VS/TS分別為13.2%和46.0%.進料脫水污泥和接種泥的碳氮比(C/N)分別為6.9:1和5.2:1.
半連續式反應器的有效容積為9 L,通過螺帶式攪拌裝置進行攪拌,內置的水浴溫控裝置能維持反應器內物料溫度為(37±1)℃.每日產氣量通過濕式氣體流量計測定.反應器的轉速為60 r·min-1,以轉動/停止為10 min/10 min方式交替運行.運行的首日向反應器內加入4 kg接種泥和1 kg基質原泥,之后連續4 d每天添加1 kg事先通過自來水配制好的含固率為15%的脫水污泥至反應體系的總體積達到9 L,從第6 d開始按照固體停留時間(solid retention time,SRT)為20 d以半連續方式進出料(每天進出料各一次).
本實驗共運行2臺反應器(R1和R2). R1在穩定運行至35 d后每天將適量的濃HCl與進料混合,在第50 d反應器pH下降至7.09±0.02,隨后穩定該pH值41 d,第92 d停止添加HCl直至實驗結束. R2在穩定運行至56 d后,開始在進料中添加30 g NH4Cl,并依據TAN分析結果分別于第58 d和第67 d加入13 g和35 g NH4Cl以使得反應器內的TAN從3 284 mg·L-1增加到5 500 mg·L-1.從第70 d開始,為了維持TAN在5 000~6 000 mg·L-1,根據出料中氨氮的流失量計算,每天在進料中加入5 g NH4Cl至實驗結束. 70~124 d這一階段FAN從穩定階段的(400±173) mg·L-1提高到了(526±25) mg·L-1.系統FAN濃度范圍最終穩定在450~600 mg·L-1(總氨氮濃度為5 000~6 000 mg·L-1)至實驗結束.
1.2 指標分析方法
平均每周采集兩次反應器的出料進行分析,測定pH、TS、VS/TS,揮發性脂肪酸(volatile fatty acids,VFAs)濃度、總堿度、總氨氮(TAN)濃度、氣體成分.每天記錄產氣量. pH測定采用實驗室用pH計(S210, METTLER, Switzerland).消化污泥樣品在13 000 r·min-1下離心20 min后進行過濾,濾液經微孔濾膜(0.45 μm)過濾后,稀釋一定倍數并加入甲酸調整pH≤2.0,再使用氣相色譜[2010 plus, Shimadzu, Japan,火焰離子化檢測器(FID)]測定VFA濃度.所使用的色譜柱為Rtx-WAX型毛細管柱(30 m×0.25 mm×0.25 μm). TS、VS/TS、總堿度和TAN濃度采用標準方法測得[13].沼氣中甲烷和二氧化碳的含量測定采用裝有熱導檢測器(TCD)的氣相色譜儀(GC112A, INESA, China),色譜柱為GDX-102(2 m×4 mm).游離氨濃度根據總氨氮濃度、pH和溫度計算得到[14], 具體計算公式如下:

(1)
式中,[FAN]和[TAN]分別為游離氨和總氨氮的濃度(mg·L-1);T為熱力學溫度(K).
VS降解率(VSreduction)由式(2)[15]計算得出(假定系統中無機組分,即不能被降解的物質的量保持恒定):
(2)
式中, VSdigestate和VSfeed分別為厭氧消化后的沼渣和進料污泥中的VS占TS的比例(VS/TS,%).
1.3 微生物分析
1.3.1 微生物種群結構分析
定期保留反應器出料于2 mL凍存管中,于-80℃冷凍保存. DNA樣品使用土壤DNA提取試劑盒(PowerSoil,MO BIO, USA)提取.分析中選用的8個R1樣品來自第28、35、42、49、77、88、109和124 d,代表了穩定、調控、抑制穩定和恢復這4個階段.所選用的16個R2樣品來自第4、10、16、21、28、35、42、49、56、58、63、70、77、84、91和102 d,代表了R2啟動、穩定、提高游離氨、高游離氨抑制穩定這4個階段.提取出的DNA經過PCR擴增,采用高通量測序(MiSeq4000, Illumina)分析其中古菌與細菌的種群結構. PCR產物先利用QuantiFLuorTM系統(Promega)測定濃度,隨后依據AxyPrep DNA試劑盒(AXYGEN, USA)的凝膠回收的方法進行提純.提純的PCR產物的質量通過凝膠電泳確定.引物設計根據Illumina公司(San Diego, California, USA)的操作手冊,針對細菌和古菌的16S rRNA基因的通用擴增引物對分別為338f (5′-ACTCCTACGGGAGGCAGCA-3′)/806r (5′-GGA CTACHVGGGTWTCTAAT-3′)[16]和344f (5′-ACGGG GYGCAGCAGGCGCGA-3′)/915r (5′-GTGCTCCCCC GCCAATTCCT-3′)[17].
1.3.2 甲烷菌定量PCR分析
本研究中根據多樣性分析結果,選取產甲烷菌中主要菌群甲烷八疊球菌科(Methanosarcinaceae),對其16S rRNA基因濃度變化進行了定量分析.定量PCR實驗采用Sybergreen熒光染料法,引物設計采用甲烷八疊球菌科16S rRNA基因的特異引物對:前引物(5′-GAAACCGYGATAAGGGGA-3′)和后引物(5′-TAGCGARCATCGTTTACG-3′)[18].使用定量PCR儀(7500 Real Time PCR System,Applied Biosystems)對Methanosarcinaceae進行定量分析. Sybergreen定量PCR反應體系為10 μL SYBR Premix Ex TaqⅡ (Tli RNaseH Plus) (2x) (TaKaRa, Japan), 0.8 μL前引物(10 μmol·L-1), 0.8 μL后引物(10 μmol·L-1), 0.4 μL ROXⅡ,2 μL模板DNA和PCR等級無菌水,最終體積為20 μL.每個樣品3個平行.反應步驟:先95℃下預變性30 s,然后經過95℃下5 s, 55℃下30 s和72℃下40 s循環40次.每一次循環的最后一個步驟檢測熒光值.
2 結果與討論2.1 游離氨調控對系統性能的影響2.1.1 降低游離氨濃度對產氣量和VS降解率的影響
R1的相關理化指標變化曲線如圖 1所示.在反應器啟動階段(0~24 d),日產氣量波動較大,并且在第13 d和第24 d出現兩個產氣高峰.該階段有大量的VFA積累,TAN含量也很高,說明啟動階段水解和產酸菌活性相對于產甲烷菌活性更高,能夠快速降解大量的大分子有機物并生成VFA,而此時產甲烷菌由于其世代周期相對較長,還不能大量增殖并及時消耗乙酸,導致VFA積累和產氣劇烈波動. 25 d后,R1的產氣量逐漸穩定,pH也穩定在7.98±0.04,穩定階段(25~35 d) FAN約為(329±40) mg·L-1. Braun等[19]利用液態的豬糞進行厭氧發酵,提出FAN在150 mg·L-1時系統就開始受到抑制,他們的反應系統在降低pH之后獲得了更好的產氣量.同樣,Zeeman等[20]在牛糞的高溫厭氧消化過程中,TAN為3 000 mg·L-1,發現在pH為7.5時,性能很差,而當他們將pH降到7.0后,由于FAN的降低,甲烷的產量增長了4倍.因此,為了使得游離氨濃度下降,減輕微生物所受的游離氨的抑制作用,獲得更好的產氣性能,從第35 d開始人為地向R1中添加HCl,使得pH逐漸下降并在50 d之后穩定在7.09±0.02.盡管FAN在50~91 d從之前的(329±40) mg·L-1下降到了(47±13) mg·L-1,但是這個階段的日產氣量平均為(10.8±0.3) L·d-1,相比穩定階段的(14.4±1.1) L·d-1卻減少了25%.由表 1可知,VS降解率也和日產氣量相似,隨著游離氨濃度下降而降低,并未出現與之前的研究[19, 20]相一致的結果.在第91 d停止添加HCl之后,pH和FAN逐漸恢復到厭氧消化的初始范圍,VS降解率和日產氣量也隨之上升.可見,在本實驗的高含固厭氧消化系統中,降低pH雖然明顯降低了FAN的濃度,但是并沒有達到預期的減輕游離氨對微生物的毒害作用進而提升系統產氣性能的目的.相反,從pH下降和回升的兩個階段的數據都可看出,pH的降低明顯影響了系統有機物的水解率和VS降解率,進而導致產酸菌和產甲烷菌的底物供給不足,最終引起產氣量的下降.
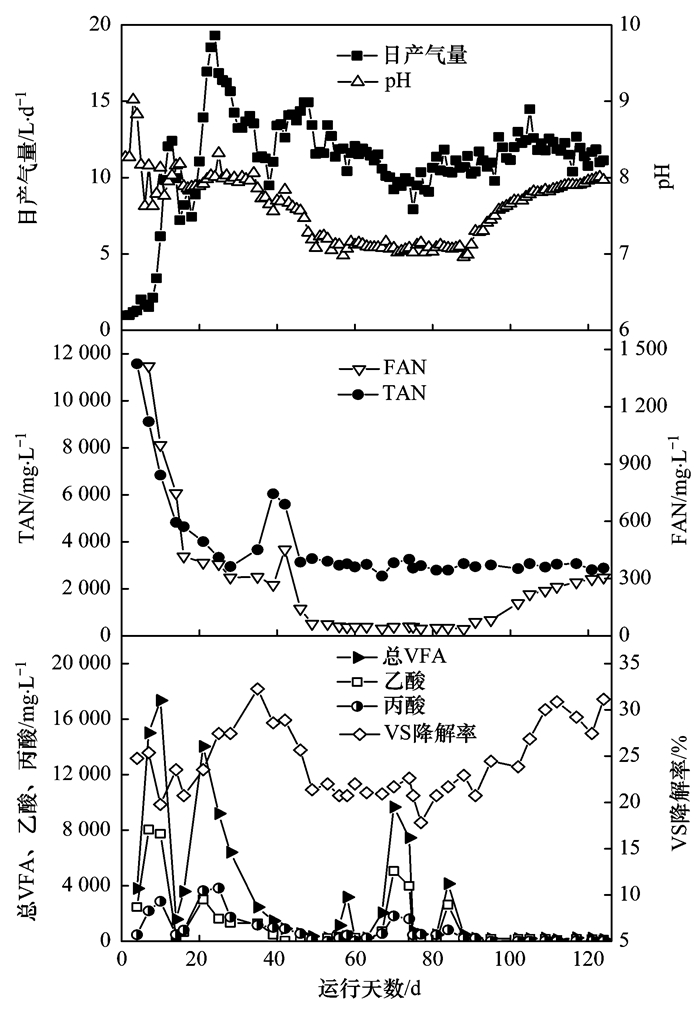
圖 1 R1的性能參數隨時間的變化曲線
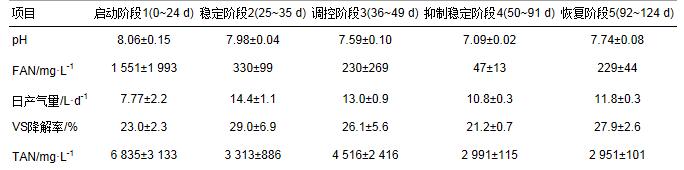
表 1 R1在不同階段的各項指標(置信區間95%)
2.1.2 提高游離氨濃度對產氣量和VS降解率的影響
與R1反應器不同,R2是通過提高TAN的濃度來調控FAN的濃度.由圖 2可知,R2在啟動階段(0~39 d)和R1相似,產氣量波動較大,在第15 d和第26 d分別出現產氣高峰. R2在40 d之后達到穩定,穩定階段(40~56 d)日產氣量為(12.0±0.3) L·d-1,VS降解率為(34.1±1.1)%,甲烷含量約為64.8%,各項性能參數與之前穩定運行的污泥高含固厭氧消化反應器接近[21].由圖 2和表 2可知,隨著FAN的提升,日產氣量和VS降解率都出現了明顯下降,相比穩定階段分別減少了14.2%和33.7%.雖然外加氨氮之后,由于NH4Cl與污泥中的OH-能進行反應,導致在提升氨氮初期H+濃度增加,pH有所下降.但是,pH的變化幅度較小,70 d以后系統pH又逐漸恢復,盡管游離氨濃度超過500 mg·L-1,但消化系統仍然能保持穩定運行,說明系統處于“抑制的穩定狀態”[3].

圖 2 R2的性能參數隨時間的變化曲線

表 2 R2在不同階段的各項指標(置信區間95%)
2.2 游離氨調控對細菌種群的影響
當通過降低pH的方式來降低R1系統中游離氨濃度時,細菌種群的變化如圖 3所示.從中可知,Candidate_division_WS 6 _norank在恢復階段含量明顯提高.然而,已有研究中尚未記載這種細菌的具體功能,因而也無法判斷其在系統中所起的作用.
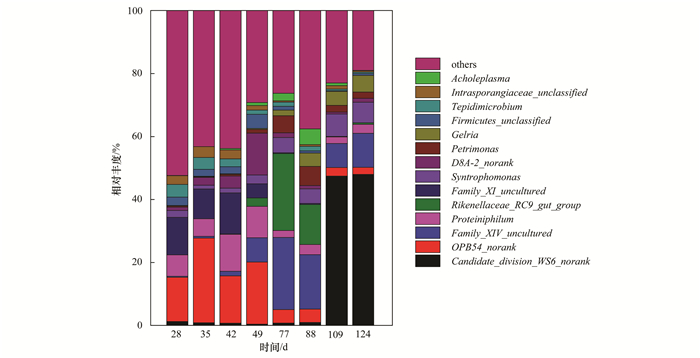
圖 3 R1中細菌相對豐度隨時間的變化
另一方面,在前兩個階段中,相對豐度占前幾位的分別為OPB 54 _norank(14%~26%)、Proteiniphilum(7%~11.7%)、Family_XIV_uncultured(5%~13%)和D8A-2_norank(1%~3.9%,其中第49 d占13.2%),在抑制穩定階段這些微生物的相對豐度全部都下降到5%以下,顯然隨著pH條件的改變,這些細菌的生長和代謝受到了影響. Proteiniphilum是一種產酸菌,主要產物是乙酸和丙酸,能夠進行解朊作用降解蛋白質并產生NH3[22].本實驗中,相對豐度隨pH下降幅度最大的細菌是OPB54 _norank. Hao等[23]利用乙酸為基質進行高溫厭氧消化,并設置了低TAN (2 600 mg·L-1)和高TAN (7 000 mg·L-1)兩組實驗,發現OPB54(具體功能未知)在兩種氨氮濃度下均是含量最多的細菌,但是在低FAN下相對豐度更高,這與本研究的結果并不一致.除此之外,一些第一階段含量較少的細菌如Tepidimicrobium(3.9%)、Macellibacteroides(1.8%)、Caldicoprobacter(1.5%)也都隨著pH調控游離氨下降而種群豐度明顯降低. Tepidimicrobium能分解葡萄糖等多種糖類,也可以降解蛋白類的物質,產物為乙酸、乙醇、H2和CO2等,有研究表明Tepidimicrobium最適宜的pH范圍是8~8.5[24, 25],本實驗中pH降低到7.1可能會是抑制該菌屬生長的一個原因.同樣情況下,由于Macellibacteroides和Caldicoprobacter是能分解糖類的細菌,他們的最終代謝產物也為小分子的VFA、H2和CO2等[26, 27],這兩類細菌豐度的下降也在一定程度上解釋了有機物含量升高的原因.由此可見,通過pH調控游離氨濃度使得系統理化環境不適宜于原本一些豐度較大的降解糖類和蛋白的產酸菌的生長,從而使得VS降解率下降.
由圖 3可知,隨著pH的調控,在抑制穩定階段,理研菌屬(Rikenellaceae_RC9 _gut_group)和Family_XIV_uncultured的相對豐度從之前的不足1%分別上升至24.3%和22.9%,Petrimonas和Acholeplasma也從不足1%分別增長到1.1%和4.9%.這其中,理研菌屬Rikenellaceae不僅可以分解碳水化合物而且還可以降解蛋白質[28].而值得注意的是,隨著游離氨濃度的上升恢復,這些微生物種群相對數量又明顯下降,比如Rikenellaceae_RC9 _gut_group相對豐度又迅速下降到1%以下,Family_XIV_uncultured也降低至2.8%.有研究表明上述這些菌屬雖然也都是進行糖類降解的產酸菌[29, 30],但從結果來看其代謝能力與Tepidimicrobium、Macellibacteroides和Caldicoprobacter相比明顯較弱.互營單胞菌屬Syntrophomonas的種群豐度在抑制穩定階段也有明顯增長,但在恢復階段并沒有下降,表明了這類微生物良好的pH適應范圍.互營單胞菌屬Syntrophomonas是一種互養型的具有氧化一些重要的中間產物如丙酸和丁酸的功能的細菌,代謝產物為乙酸和H2,該細菌必須要和能夠消耗H2的微生物共同培養才能夠生長[31],屬于互養型的降解途徑. Syntrophomonas在FAN升高時會受到抑制,在研究不同的工程規模[32]或者實驗室規模[33]的厭氧反應器中的微生物種群結構時發現高游離氨濃度的反應器里例如Syntrophomonas、Pelotomaculum、Desulfobulbus等互養型微生物較低游離氨的反應器含量更少,顯示互養型代謝更易受到游離氨的抑制.當為了降低游離氨濃度而控制pH值至7.0之后,系統中承擔糖類和蛋白的降解的微生物類型發生了轉化,之前豐度較大的該類細菌種群相對數量都出現降低,而另一些之前豐度較小的細菌含量增加,與此同時反應器的有機物降解性能和產氣性能出現下降.
而當通過外加氨氮提高R2系統中游離氨濃度時,細菌種群的變化如圖 4所示, R2反應器中3種主要的優勢細菌種群,在啟動階段,Tepidimicrobium和Proteiniborus的相對豐度分別在第21 d和第16 d達到各自的最高值33.8%和15.8%.而后,兩種細菌都在35 d下降,分別為18.3%和6.2%.細菌種群的豐度在穩定階段保持基本不變,除了Anaerobranca在第42 d有一個激增.當第56 d開始,隨著R2內游離氨濃度的不斷上升,Anaerobranca也出現了明顯的隨之上升的趨勢,而Tepidimicrobium和Proteiniborus則表現出隨著FAN上升而降低的趨勢. Tepidimicrobium是一種解胨型的細菌,可以以多種蛋白質的物質為基質來維持自己的生長[25],在R1和R2兩組實驗中,都發現了Tepidimicrobium的相對豐度隨著游離氨的變化明顯地改變,即不論是游離氨濃度提高還是降低,Tepidimicrobium的豐度都有所下降.和Tepidimicrobium類似,Proteiniborus也可以在pH值6~8的范圍里利用蛋白質作為發酵底物[34]. Anaerobranca本質上也是分解蛋白質的細菌[35]. Prowe等[36]發現Anaerobranca只包含幾種可以厭氧發酵蛋白轉化為乙酸的厭氧微生物.本實驗中第42 d Anaerobranca的增多同時也伴隨著游離氨濃度的上升,可以看出當游離氨濃度變高的時候,Anaerobranca在整個蛋白的分解過程中所起的作用更大.而Anaerobranca對蛋白質的降解速率可能小于Tepidimicrobium和Proteiniborus,從而導致系統VS降解率的下降.
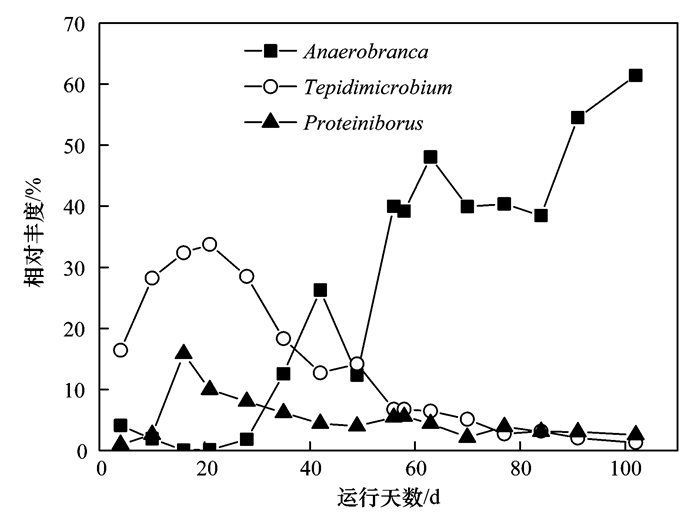
圖 4 R2中3種優勢細菌相對豐度隨時間的變化
2.3 游離氨調控對產甲烷菌種群的影響
由圖 5可知,R1反應器中游離氨濃度下降之后,氫利用型的甲烷囊菌屬(Methanoculleus)的相對豐度明顯降低,從13%下降到1.9%,并且在恢復階段也未能完全恢復至原有水平,繼續下降至不足1%.而整個過程中,乙酸型的甲烷八疊球菌屬(Methanosarcina)相對豐度一直大于80%,在與甲烷囊菌屬的競爭中,隨著游離氨濃度和pH的下降,逐漸占據了更大的優勢,最后豐度甚至達到97%.但是因為系統的產氣量和VS降解率隨著FAN和pH的下降而降低,為了更準確地觀察游離氨及pH對產甲烷菌種群尤其是甲烷八疊球菌(Methanosarcina)的影響,通過定量PCR的分析而獲得其16S rRNA基因濃度的變化趨勢來定量分析甲烷菌種群的動態變化.由圖 6知,R1反應器內相對豐度最大的甲烷八疊球菌的16S rRNA基因濃度(以濕泥計,下同)在第28 d和35 d分別為(1.27×106±8.0×104) copies·g-1和(1.19×106±9.89×104) copies·g-1,之后盡管pH不斷降低,但依然維持在同一個數量級內,波動變化不大.而到了第88 d 16S rRNA基因濃度明顯下降,為(1.27×105±1.22×104) copies·g-1,這時系統pH值已經在7.1維持了38 d,約2個SRT,顯然之前pH為7左右的長時間作用已經使得較多的甲烷八疊球菌受到底物持續供給不足的影響.之后隨著FAN和pH的回升,甲烷八疊球菌16S rRNA基因濃度又回升至106 copies·g-1的數量級水平.可見產甲烷菌種群在通過pH調控游離氨的過程中由于細菌種群結構的影響而受到基質供給不足的抑制,但隨著pH的回升又較快恢復了活性.
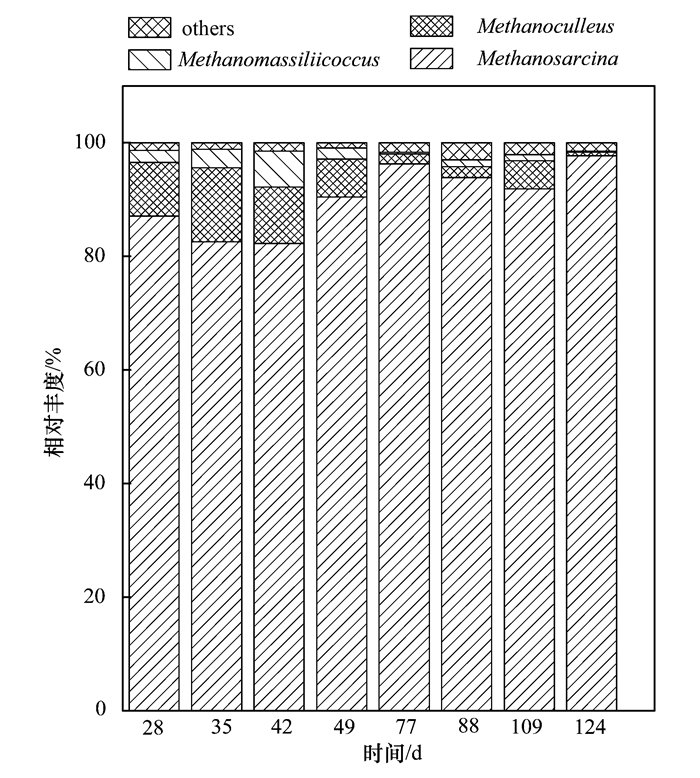
圖 5 R1的古菌在屬的水平上隨時間的變化
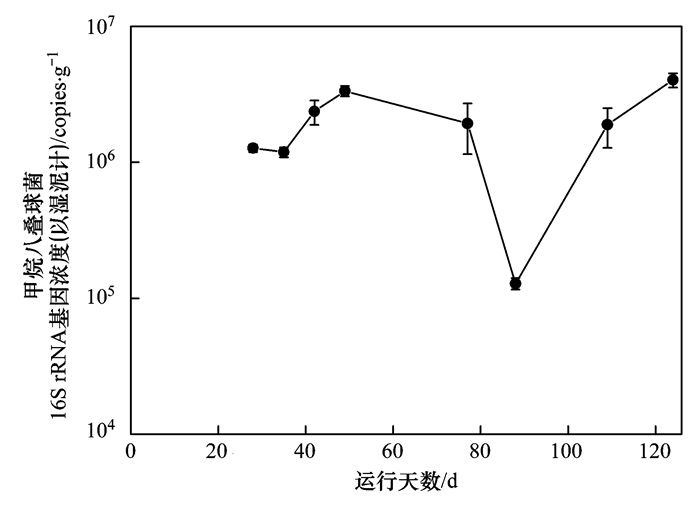
圖 6 R1甲烷八疊球菌數量隨時間的變化(n=3)
R2樣品的古菌多樣性分析結果如圖 7所示,乙酸型的甲烷八疊球菌Methanosarcina為優勢種群,在整個實驗過程中占古菌的比例一直在92%以上,說明甲烷八疊球菌可能并沒有受到游離氨濃度提高的抑制.定量PCR的結果也表明在游離氨濃度從(400±173) mg·L-1提高到(526±25) mg·L-1之后,R2內的甲烷八疊球菌的16S rRNA基因平均濃度從(3.43×106±2.91×106) copies·g-1變化為(3.58×106±1.18×106) copies·g-1,數量基本相同.因而,有機物降解受到抑制的主要原因應該來源于細菌種群結構所受的影響[37].具體參見污水寶商城資料或http://www.jianfeilema.cn更多相關技術文檔。
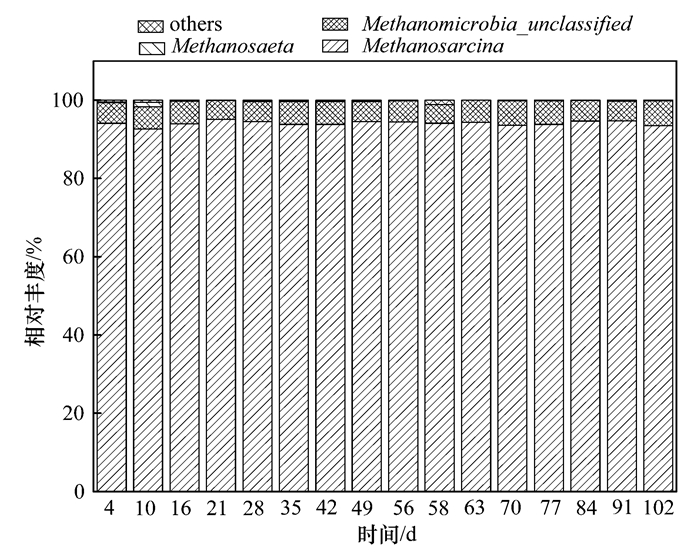
圖 7 R2的古菌在屬的水平上隨時間的變化
3 結論
(1)當FAN從(400±173) mg·L-1提高到(526±25) mg·L-1后,相比正常的消化狀態,系統的日產氣量和VS降解率分別降低了14.2%和33.7%,但依然能在抑制的狀態下穩定運行.
(2)當通過pH調控使得FAN從(330±99) mg·L-1下降至(47±13) mg·L-1,系統的日產氣量和VS降解率分別降低了25%和26.9%,而隨著pH和FAN恢復至正常水平,系統的產氣性能和VS降解率又恢復至原有水平,相比抑制穩定階段分別提高了9.3%和31.6%.
(3)本文中的兩種游離氨調控方式都會影響污泥高含固厭氧消化系統中細菌的種群結構.投加外來氨氮后,過高的FAN (500~600 mg·L-1)會使得降解蛋白的細菌種類朝著蛋白降解率更低的細菌菌群轉變,但并沒有影響到主要的產甲烷菌(甲烷八疊球菌)的生長;另一方面,通過降低pH來降低游離氨的濃度并不一定能使得性能提高,反而可能會由于pH的變化影響一些的糖類和蛋白質類發酵細菌的活性,導致水解效率的下降,引發后續產甲烷菌的底物供給不足,削弱系統產氣性能.(來源及作者:同濟大學環境科學與工程學院 戴曉虎、何進、嚴寒、李寧、丁月玲、董濱、戴翎翎)


