活性污泥法是以活性污泥為核心的廢水生物處理技術,其中對污染物降解起關鍵作用的是活性污泥中的細菌[1],而作為細菌的捕食者——微型動物在維持細菌群落活力[2],為活性污泥中的細菌提供礦物營養[3],維護活性污泥微環境生態食物鏈健康[4],維持活性污泥系統穩定[5]發揮重要作用,可作為活性污泥法廢水處理效能的指示生物[6~9].
水中存在的有毒有害物質一方面會對活性污泥中的不同類別細菌產生不同程度的抑制效應,對細菌群落結構產生影響,進而通過食物鏈的傳遞影響到處于食物鏈頂端的微型動物的群落結構[10];另一方面,毒害物直接對微型動物產生毒害效應,如重金屬離子[11, 12],從而對活性污泥微型動物群落結構產生重要影響.
苯酚是生產某些聚合樹脂、造紙、精煉石油以及藥物(如阿司匹林)等工業過程生產廢水中的主要污染物[13],當進入廢水生物處理系統時,會對活性污泥微生物產生影響,從而影響到廢水處理效果.目前,苯酚對活性污泥處理系統的毒害研究主要集中于活性污泥處理性能[14, 15]、污泥特性[16]、代謝機制[17]、動力學[18]和細菌群落結構[19]等方面.為了篩選出苯酚對活性污泥處理性能(運行參數、處理效果等)的指示生物而進行了少量的微型動物研究[8, 20],而未從群落結構動態變化的角度揭示苯酚對活性污泥的微生態系統的長期影響機制.
本研究的主要目的是基于序批式活性污泥處理系統(SBR),探究含酚廢水對活性污泥活性及微型動物群落結構的持續負荷影響,并探討污泥活性與微型動物群落之間的關系,篩選污泥活性指標的指示生物,以期為含酚廢水生物處理系統的生產運行提供生物學理論及技術依據.
1 材料與方法
1.1 裝置啟動與運行控制
自制序批式反應器(SBR),其主體由高85 cm、內徑7.5 cm的有機玻璃柱制成,有效容積為3.2 L.空氣壓縮機通過置于反應器底部的微孔曝氣頭提供系統所需氧氣,同時為泥、水的混勻與環流提供動力.通過調節空氣流量計控制曝氣強度(0.2 L ·min-1),維持水中穩定的溶解氧(DO)[(6.02±0.47) mg ·L-1].反應器在室溫[(21.6±4.2)℃]下運行.分別設置對照系統CK(進水不添加苯酚)和試驗系統EK[進水添加苯酚(aladdin試劑,分析純)]這2個系統.
接種污泥取自馬鞍山市某污水處理廠好氧池,采用自來水對污泥進行清洗并均混后分別投加至2個反應器,悶曝2 d后,混合液懸浮固體濃度(MLSS)分別為2 753 mg ·L-1和2 669 mg ·L-1,污泥沉降比(SV)均為22%.然后進行污泥培養馴化,培養原水由靜置48 h的自來水混合配制而成,水中投加一定量的C6H12O6、 NH4Cl、 KH2PO4(微量元素來源于試驗用水),使BOD :N :P之比接近100 :5 :1.用NaHCO3/Na2CO3緩沖體系(pH=9.25)調節進水pH(7.60±0.10).通過系統中活性污泥微型動物群落物種多樣性及出水水質等指標判定[11],系統運行約30 d,活性污泥達初步成熟,完成馴化,進行正式試驗.
正式試驗分成3個階段,在培養原水中加入不同量高濃度苯酚溶液(50g ·L-1),使第1、第2、第3階段原水中苯酚溶液濃度分別為50 mg ·L-1(低濃度)、 100 mg ·L-1(中等濃度)和300 mg ·L-1(高濃度);試驗期間,系統的進水水質控制在COD為(839.04±87.70) mg ·L-1、氨氮為(45.22±4.95) mg ·L-1、總磷為(6.65±0.34) mg ·L-1,系統中污泥負荷(以COD/MLSS計)約為0.25 kg ·(kg ·d)-1.
正式試驗期,反應器采用間歇曝氣的方式運行(曝氣和沉淀交替進行,時間均為2 h),每天運行2個周期,每個周期12 h.在每個周期沉淀結束前將反應器中上清液通過出水口排出,排水比(進水體積與反應池總有效體積之比)為1/3.2,然后補入新鮮原水至原水位,重新進入下一個周期運行,如此循環往復.通過每日在曝氣階段末期排放一定量泥水混合液的方式控制MLSS在4 000 mg ·L-1左右,并控制污泥齡θ為25 d.
1.2 樣品采集及微型動物鑒別計數與分類
正式試驗開始后,每隔1~2 d在第1個周期(08:00~20:00)最后一個曝氣階段結束前30 min內,通過虹吸管在反應器垂直方向上等距離(反應器底部往上10、 40、 70 cm處)采集3個污泥混合液平行樣用于微型動物鑒別計數.
使用微量移液器(DRAGON大龍)移取25 μL[單獨取樣鑒別統計小型鞭毛蟲(flagellates)(≤20 μL)時取樣量為5 μL]搖勻后的污泥混合液置于光學顯微鏡(PH50系列, ×100或×400)下對微型動物進行鑒別、計數.根據形態學和行為學特征并依照圖譜、文獻[21, 22]將微型動物按需要鑒定到種或類群.原生動物均鑒定到種,輪蟲(rotifers)、線蟲(nematodas)等微型后生動物鑒定到類群[23].鑒定工作在5 h(最長不超過8 h)內完成,以避免微型動物數量和物種豐富程度在鑒別過程中改變[23, 24].將微型動物群落中常見的纖毛蟲類原生動物分為菌食性纖毛蟲(Bacterivorous ciliates)和肉食性纖毛蟲(Carnivorous ciliates),其中菌食性纖毛蟲又分為匍匐型纖毛蟲(Crawling ciliates)、固著型纖毛蟲(Sessile ciliates)和游泳型纖毛蟲(Swimming ciliates)等三大類群[23],將微型動物數量所得數據折算成個·mL-1.
1.3 污泥活性與水質及污泥常規指標測定
每隔2~3 d在第1個周期最后一個曝氣階段結束前30 min內取一定量的泥水混合液進行污泥電子傳遞體系(electron transport system, ETS)包括TTC-ETS和INT-ETS活性測定[25, 26].其中,抑制率(IR)計算公式為:
式中,R0為對照系統測定值,R為試驗系統測定值.
在進水曝氣后的1 min內取少量混勻后的泥水混合液過濾(0.45 μm微濾膜),采用紫外-可見分光光度法(上海儀電752N)測定濾液中實際苯酚濃度(最大吸收波長為270 nm).其他指標:化學需氧量(COD)、氨氮(NH4+-N)、總磷(TP)按照標準方法[27]測定;污泥沉降比(SV)采用30 min沉降直接讀數法測定;混合液懸浮固體濃度(MLSS)采用重量法測定;溶解氧(DO)和水溫(T)采用便攜式溶解氧測定儀(雷磁JPBJ-608)測定;pH值采用數顯pH計(雷磁PHS-25)測定.
1.4 數據處理分析
采用Shannon-Wiener指數[28]H′表征活性污泥微型動物群落物種多樣性,其計算公式:

式中,S表示物種種數,pi表示第i個種的個體數占所有物種總數的百分比.
所有微型動物統計數據均取3個平行樣平均值進行分析.統計分析采用軟件SPSS 19.0進行Pearson相關性、 LSD多重比較(α=0.05)和主成分分析(PCA),其中Pearson相關性分析之前需將所有原始數據按對數公式x=ln(x+1)進行轉換.采用Origin 9.0和Excel 2007完成相關圖表制作.
2 結果與討論 2.1 污泥活性對苯酚毒害效應的響應及其變化
在整個試驗過程中,兩個活性污泥系統的處理效果沒有明顯的差異(P>0.05)[試驗過程中,兩個系統COD和NH4+-N去除率分別為(95.38±4.41)%、 (97.06±2.42)%和(98.92±1.58)%、 (98.46±2.29)%],可能的原因是在足夠長的反應時間(本試驗曝氣反應時間為6 h)條件下對一定范圍內濃度(<400 mg ·L-1)的進水苯酚能夠作為碳源的一部分被細菌充分降解,以致對活性污泥處理效果不產生明顯影響[14, 16].但進水濃度在400 mg ·L-1以下的苯酚對好氧污泥形態、比耗氧速率(SOUR)[16]以及活性污泥微型動物群落種屬組成[20]均有明顯的影響.
電子傳遞體系(ETS)活性可表征活性污泥系統中的微生物活性[26, 29~31],揭示系統硝化反硝化規律[26],表征重金屬對污泥活性的影響[32, 33]. TTC-ETS和INT-ETS是用于檢測污泥ETS活性的常用方法[34],兩者因氧化還原電位大小以及從呼吸鏈上接受電子的部位不同(后者較早地從呼吸鏈上接受電子)而對污泥活性的響應不同[25, 35].然而,是否可以采用污泥ETS活性表征酚類有機毒害物質對污泥活性的影響,未見報道.本研究通過測定TTC-ETS活性和INT-ETS活性,分析比較確定適用于有機毒害物苯酚對污泥活性影響的有效表征指標,以揭示在苯酚毒害效應影響下污泥活性的變化規律.不同進水苯酚濃度持續負荷條件下污泥TTC-ETS活性、 INT-ETS活性及其動態變化如表 1和圖 1所示.

圖 1 苯酚對活性污泥TTC-ETS活性和INT-ETS活性的影響

表 1 不同進水苯酚濃度持續負荷條件下污泥ETS活性1)
從圖 1(a)中可以看出,在整個試驗期間內,對照系統CK、試驗系統EK中的污泥TTC-ETS活性分別為(200.26±65.57) μg ·(mg ·h)-1、 (152.91±63.63)μg ·(mg ·h)-1,均存在較大波動,且變化趨勢相近,這與前人的研究結論[31]相一致,即進水水質等運行參數的改變不會影響SBR系統中污泥TTC-ETS活性的變化趨勢.當進水苯酚為低濃度(50 mg ·L-1)時,苯酚的毒害效應對系統中污泥TTC-ETS活性的影響并不顯著(P=0.499),其抑制率IR僅為(20.75±10.43)%(圖 2,下同);當進水苯酚濃度增加到100 mg ·L-1時,CK、 EK兩個系統中TTC-ETS活性均隨運行時間變化而有所增大,且EK系統的TTC-ETS活性此階段的初期更大,試驗第36 d為230.30 μg ·(mg ·h)-1,比CK系統[168.57 μg ·(mg ·h)-1]大36.62%,這說明適當濃度的苯酚會短暫地促進污泥TTC-ETS活性的增大. ETS活性表征污泥活性的方法實質上是通過測定好氧微生物的呼吸活性來間接指示活性污泥的生物活性[34],故適當濃度的苯酚短時間內能夠通過促進TTC-ETS活性的增長(活性污泥中微生物的呼吸增強)來增強微生物(包括微型動物,下同)對苯酚毒性生存環境的適應.隨后TTC-ETS活性開始降低,系統運行第46 d,試驗系統中污泥TTC-ETS活性達到最低的32.61 μg ·(mg ·h)-1,僅有對照系統的18.66%,抑制率高達81.34%.這是因為隨著時間的推移,苯酚在活性污泥中得到累積,超過污泥中微生物的耐受閾值,微生物開始大量死亡,導致污泥活性急劇降低,污泥TTC-ETS活性呈現出急劇減小的趨勢.第50 d,兩個系統中的污泥TTC-ETS活性逐步增大,且兩者的差距逐漸縮小,這是由于試驗系統中的活性污泥某些微生物通過馴化,逐步適應了有毒的生存環境,大量繁殖的結果.總的看來,進水苯酚濃度為100 mg ·L-1時,試驗系統與對照系統中污泥TTC-ETS活性存在顯著差異(P=0.045)(表 1,下同),說明此濃度下的苯酚毒性對污泥活性產生了明顯的抑制效應;進一步增大進水苯酚濃度至300 mg ·L-1,試驗系統與對照系統中的污泥TTC-ETS活性差異性進一步增大(P=0.008),但在這一階段后期,苯酚對污泥TTC-ETS活性的抑制率相對穩定在40%左右.

不包括0~100%以外的數據 圖 2 苯酚對活性污泥TTC-ETS活性、INT-ETS活性的抑制影響
圖 1(b)表明:在整個試驗過程中試驗系統和對照系統具有相近的INT-ETS活性變化規律,這與TTC-ETS活性類似.然而,LSD多重比較分析結果表明(表 1),進水苯酚濃度在50~300 mg ·L-1范圍內,苯酚對污泥INT-ETS活性幾乎沒有顯著影響(P>0.05),這可能是因為INT較早地從呼吸鏈上接受電子,只有細胞色素b之前的電子傳遞過程被阻斷后其活性才能受到抑制,因此INT-ETS活性受影響的概率要小一些[25].此外,TTC氧化還原電位(460 mV)明顯高于INT氧化還原電位(90 mV)[35],TTC作為人工電子受體時在進水濃度在50~300 mg ·L-1范圍內的苯酚毒害作用下更容易接受電子發生電化學反應,故污泥TTC-ETS活性比INT-ETS活性更加敏感,更適合作為苯酚對好氧污泥活性毒害效應的響應指標,以反映苯酚對好氧污泥活性的影響規律.
2.2 苯酚對活性污泥微型動物群落結構的影響
2.2.1 苯酚對活性污泥微型動物形態的影響
在試驗過程中發現,隨著苯酚濃度的增大,試驗活性污泥系統中開始出現體型與微型動物大小相近的胞囊(其個體大小為100~300 μm),如蟲體收縮狀態下的輪蟲[圖 3(a)],其數量變化規律如圖 3(b)所示.由圖 3(b)可知,在低濃度條件下,未觀察到胞囊,當進水苯酚濃度增大至100 mg ·L-1時,一些微型動物(由觀察到的胞囊大小可以判斷出并非所有微型動物都形成胞囊)為了避免苯酚毒性環境的毒害,纖毛等消失,身體向內收縮成橢圓形,并在體外積累一層保護膜形成胞囊,這一現象在韋貞鴿等[36]的相關研究中也觀察到了.此時,胞囊開始大量出現,第37 d達最大值(4 640個·mL-1).隨后開始急劇減少,到第二階段結束時減至173個·mL-1,在高濃度(300 mg ·L-1)條件下,胞囊數量仍較少,試驗結束時,幾乎觀察不到胞囊,說明過高濃度(>300 mg ·L-1)的苯酚其毒害作用使微型動物形成胞囊的生存機制失效,大量死亡而消失.胞囊是微型動物對毒性的形態適應方式,是一種自我保護的生存機制,也是影響微型動物群落結構動態變化的原因之一,但由于胞囊只是微型動物的休眠體,以下對活性污泥微型動物群落結構進行分析時,不包括胞囊.

圖 3 苯酚毒害作用下微型動物形成的胞囊(100倍)及其數量變化規律
2.2.2 苯酚對活性污泥微型動物群落結構的影響
不同濃度苯酚毒害作用下,活性污泥微型動物群落結構如表 2所示.
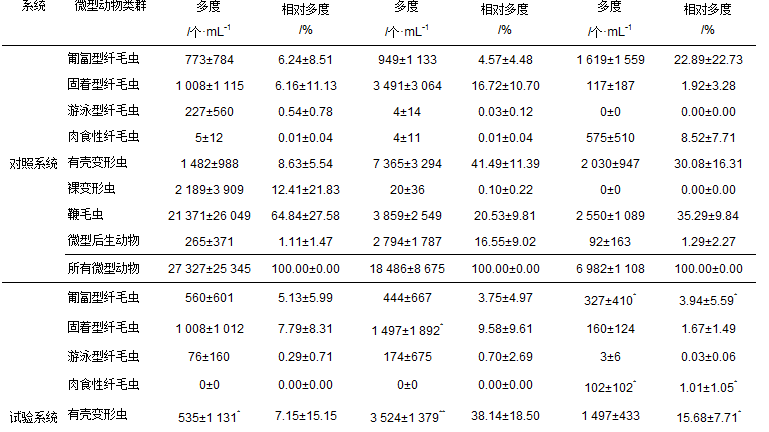
表 2 活性污泥系統中微型動物群落不同類群的多度和相對多度1)
從表 2中可知,兩個系統中微型動物群落類群組成均在不同運行階段而所有不同.當進水苯酚濃度為50 mg ·L-1時,除有殼變形蟲(P=0.026)外,兩個活性污泥系統中的微型動物群落不同類群多度[單位體積(mL)泥水混合液中微型動物個體總數]均不存在顯著性差異(P>0.05),整個群落多度也不存在顯著性差異(P=0.904),且所有微型動物類群相對多度均不存在顯著性差異(P>0.05),說明低濃度苯酚對活性污泥微型動物群落結構沒有顯著性影響;當進水苯酚濃度增加至100 mg ·L-1時,苯酚對微型動物群落中的固著型纖毛蟲(P=0.041)、有殼變形蟲(P=0.000)、微型后生動物(P=0.025)等類群以及整個微型動物群落多度(P=0.018)均產生顯著性影響,其中裸變形蟲和鞭毛蟲的相對多度(物種個體數占所有物種總數的百分比)與對照系統相比存在顯著性差異(P < 0.05),說明當進水濃度為100 mg ·L-1時,苯酚會對活性污泥微型動物群落結構產生明顯的影響;進一步增大進水苯酚濃度至300 mg ·L-1,與對照系統相比,試驗活性污泥系統中的匍匐型纖毛蟲(P=0.04)、肉食性纖毛蟲(P=0.022)、鞭毛蟲(P=0.004)也存在顯著性差異(P < 0.05),且整個微型動物群落多度差異進一步增大(P=0.014),說明高濃度苯酚長期作用下對活性污泥微型動物群落不同類群產生不同影響:一方面,高濃度苯酚對微型動物群落中的多數類群的生長繁殖存在明顯的抑制作用,如匍匐型纖毛蟲、肉食性纖毛蟲、有殼變形蟲、裸變形蟲等.另一方面,高濃度苯酚對微型動物群落中的某些類群的生長繁殖也存在明顯的促進作用,如鞭毛蟲.試驗系統鞭毛蟲多度[(7 850±4 198)個·mL-1]顯著大于對照系統[(2 550±1 089)個·mL-1](表 2),其相對多度達(70.72±20.77)%,成為優勢類群.可能的原因是:①在較高濃度苯酚長期作用下,苯酚在活性污泥中累積(水中實際濃度達80~100 mg ·L-1),細菌活力受到抑制,其凝聚能力降低,污泥絮體粒徑變小[16],不利于爬行或附著于污泥絮體表面捕食細菌的匍匐型和固著型纖毛蟲[37]生長繁殖,而有利于游離于絮體表面活動的鞭毛蟲存活,從而使其在微環境食物鏈中對細菌的捕食更有競爭力而快速繁殖;②相對于體型較大的纖毛蟲原生動物,鞭毛蟲[尤其是異養型鞭毛蟲(HNAN)]對游離細菌的捕食效率更高[38],因而生長繁殖旺盛.此外,高濃度苯酚對微型后生動物中線蟲的生長繁殖也有促進作用.更重要的是,與對照系統相比,試驗系統中的匍匐型纖毛蟲(P=0.038)、肉食性纖毛蟲(P=0.016)、有殼變形蟲(P=0.040)、鞭毛蟲(P=0.001)的相對多度均存在顯著性差異(表 2),說明高濃度苯酚的進入會對活性污泥微型動物群落結構產生更為顯著的影響.
有研究者認為不同種類在群落中的數量分布曲線是表現群落結構的一個重要指標[21],故在此基礎上獲得的Shannon-Wiener指數H′可以反映群落結構差異.為了進一步揭示苯酚濃度大小對活性污泥微型動物群落結構的影響程度,對不同濃度條件下微型動物群落物種多樣性指數進行主成分分析,結果如圖 4所示.從中可知,選取的2個主成分貢獻率分別為52.08%、 19.69%,累積貢獻率達71.77%.低濃度苯酚持續負荷作用下的活性污泥微型動物群落物種多樣性及相應對照系統與PC1和PC2均呈正相關,中等濃度苯酚持續負荷作用下的活性污泥微型動物群落物種多樣性與PC1和PC2均呈正相關,而其相應對照系統中的微型動物群落物種多樣性與PC2呈負相關,即兩者差異明顯,說明中等濃度苯酚進水較之低濃度苯酚進水對活性污泥微型動物群落結構影響更大.進一步分析,除對照系統高濃度苯酚持續負荷作用下的微型動物群落物種多樣性指數與PC1呈負相關外,其余條件下的微型動物群落物種多樣性均與PC1呈正相關,說明高濃度苯酚長期作用下,活性污泥系統中的微型動物群落物種多樣性發生了更為明顯的變化,即群落結構受到了明顯影響.樣方之間距離大小反映了方間特征量的相似程度,且距離越近相似程度越高[39].從樣方距離來看,低濃度苯酚和中等濃度苯酚對活性污泥微型動物群落物種多樣性的影響相接近,而高濃度苯酚作用下的微型動物群落與對照系統相比距離最大,說明高濃度苯酚對微型動物群落物種多樣性影響最大,即高濃度苯酚對活性污泥微型動物群落結構影響最大,這與前文分析結果相一致.

圖 4 不同濃度苯酚影響下活性污泥系統中微型動物群落物種多樣性主成分分析(PCA)
2.2.3 苯酚影響下活性污泥微型動物群落結構動態變化
活性污泥系統中不同類群微型動物相對多度隨運行時間的動態變化如圖 5所示.兩個系統中不同類群的微型動物其相對多度隨運行時間均有較大變化,這與城市廢水活性污泥處理系統相一致[37, 40].但不同濃度的苯酚影響下,微型動物群落結構隨時間的變化有所不同.具體地,在第1階段低濃度苯酚進水條件下,除有殼變形蟲外,苯酚對微型動物群落不同類群相對多度隨時間變化的影響不明顯,兩個系統中鞭毛蟲多度均占據了長時間的絕對優勢,其相對多度分別達(64.84±27.56)%、 (75.05±28.18)%,兩者無顯著性差異(P=0.342),其他類群相對多度較小,且各類群的微型動物相對多度隨時間變化趨勢線上的拐點所在時間軸的位置相對差異較小(圖 5);試驗第2階段,兩個系統中各微型動物類群分布相對第1階段較均勻,在這一階段有殼變形蟲成為優勢類群,但試驗系統中有殼變形蟲前期(32~45d)受到了抑制,對照系統和試驗系統中有殼變形蟲相對多度分別為(34.31±7.66)%、 (25.66±18.18)%,后者波動也較大.在這一階段,苯酚對固著型纖毛蟲也產生了明顯的抑制,其相對多度處于較低水平[(9.58±9.61)%],而鞭毛蟲相對多度[(33.76±13.80)%]顯著大于后者[(20.53±9.81)%](P=0.005);試驗第3階段,對照系統中微型動物群落各類群分布較均勻,而試驗系統中鞭毛蟲占絕對優勢,試驗結束前其相對多度達最大值的91.13%.此外,與對照系統相比,試驗系統中的匍匐型纖毛蟲和肉食性纖毛蟲受到了明顯的抑制,前者運行70 d幾乎消失,而后者相對多度一直處于極低水平[(1.01±1.05)%].

(a)對照系統,(b)試驗系統 圖 5 兩個活性污泥系統中微型動物群落結構動態變化
2.3 苯酚影響下的污泥活性與微型動物間的相互關系探討
如前文所述,污泥TTC-ETS活性比INT-ETS活性更加敏感,更適合作為苯酚對好氧污泥活性毒害作用的響應指標,故選擇TTC-ETS活性作為苯酚影響下污泥活性的表征指標.不同進水濃度苯酚作用下污泥TTC-ETS活性的變化規律[圖 1(a)]與活性污泥微型動物群落結構動態變化(圖 5)對比分析可知,污泥TTC-ETS活性與微型動物群落結構相互之間存在著一定的關聯,如低濃度苯酚對污泥TTC-ETS活性及微型動物群落結構的影響均不明顯;當進水濃度達100 mg ·L-1時,苯酚對污泥TTC-ETS活性及微型動物群落結構產生明顯的影響;進一步增大進水濃度時,這種影響顯著增大.活性污泥是活性污泥處理系統中的主體,而活性污泥微生物是活性污泥污染物降解核心,因此活性污泥微生物ETS活性對活性污泥處理系統的正常運行有著重要意義[41],而在活性污泥微環境生態系統中微型動物作為食物鏈頂端的捕食者,在維持活性污泥微環境生態系統的穩定發揮著重要作用,因此,活性污泥活性與微型動物群落結構之間也必然存在聯系.活性污泥微型動物與污泥活性Pearson相關性分析結果如表 3所示.
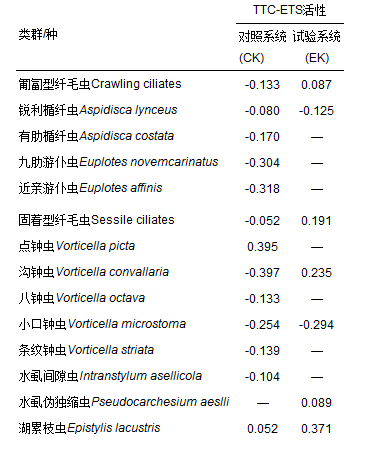
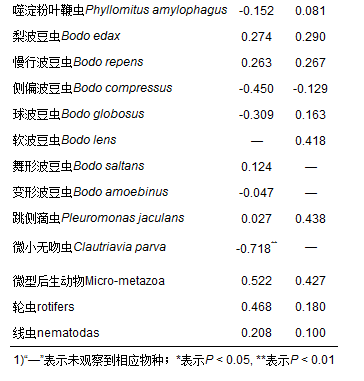
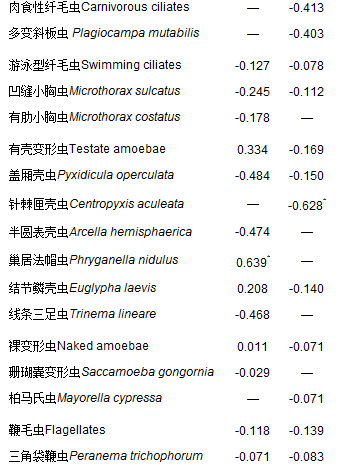
表 3 活性污泥微型動物與污泥活性Pearson相關性
水中毒害物質的存在使微型動物群落與所處的微生態環境之間的關系復雜化[42],兩個活性污泥系統中的微型動物同一個種與對應污泥活性之間的相關性不同(表 3).為了使所篩選的指示生物對含酚廢水活性污泥處理工藝的操作運行具有實際指導意義,選擇含苯酚進水系統(即試驗系統)作為分析對象,以篩選出含酚廢水活性污泥法處理過程中對污泥TTC-ETS活性具有指示價值的微型動物種.在試驗過程觀察到的活性污泥微型動物群落物種中與污泥活性顯著相關的種只有針棘匣殼蟲(Centropyxis aculeata,r=-0.628, P < 0.05),說明針棘匣殼蟲的大量繁殖,預示著處理含酚廢水的污泥活性低.此外,其他微型動物種如湖累枝蟲(Epistylis lacustris,r=0.371, P=0.173)、多變斜板蟲(Plagiocampa mutabilis,r=-0.403, P=0.137)、軟波豆蟲(Bodo lens,r=0.418, P=0.121)、跳側滴蟲(Pleuromonas jaculans, r=0.438, P=0.102)等與污泥活性也存在明顯的相關性(|r|為0.3~0.5),也可作為含酚廢水處理過程中污泥活性的指示生物.
以前的研究都是通過篩選與廢水處理指標緊密相關的微型動物種作為活性污泥處理性能某些指標的指示生物[9, 43~45],而本研究說明某些微型動物種與污泥ETS活性之間存在著明顯的相關性,即也可作為活性污泥廢水處理過程中ETS活性的指示生物.
3 結論
(1) 比較分析TTC-ETS活性及INT-ETS活性等兩個ETS活性指標結果表明,污泥TTC-ETS活性能夠更有效表征苯酚對污泥活性的影響,且隨著進水苯酚濃度的增大,苯酚對污泥活性的抑制越明顯,如50 mg ·L-1進水條件下,苯酚對污泥活性的抑制率為(20.75±10.43)%,而300 mg ·L-1進水運行后期,其抑制率穩定在40%左右.
(2) 苯酚對活性污泥微型動物群落結構的影響隨濃度的增大而增大,且對不同微型動物類群影響不同.在50 mg ·L-1進水條件下,苯酚只對有殼變形蟲存在明顯的抑制作用,而進水濃度增大至100 mg ·L-1時,苯酚對固著型纖毛蟲、有殼變形蟲、微型后生動物等類群以及整個微型動物群落均產生顯著性影響.當進水濃度為300 mg ·L-1時,苯酚對匍匐型纖毛蟲、肉食性纖毛蟲的生長繁殖均有明顯的抑制作用,而對鞭毛蟲的生長卻存在明顯的促進作用.
(3) 苯酚對活性污泥微型動物群落結構的動態變化有影響,且進水濃度不同對微型動物群落結構動態隨時間變化的影響程度不同.隨著苯酚濃度的增大,某些微型動物會形成胞囊自我保護,這種自我保護的生存機制可能是影響微型動物群落結構動態變化的原因之一,但進水苯酚濃度過高(>300 mg ·L-1)時,會導致這種生存機制逐漸失效.
(4) 苯酚影響下的污泥活性與微型動物之間存在某種程度的關聯,某些微型動物種可作為污泥活性大小的指示生物,如針棘匣殼蟲(Centropyxis aculeata)的大量繁殖,預示著處理含酚廢水的污泥活性低;湖累枝蟲(Epistylis lacustris)多度與污泥活性呈明顯的正相關關系(r=0.371, P=0.173),可作為污泥活性高的指示生物等.(來源及作者:安徽工業大學建筑工程學院 胡小兵、饒強、唐素蘭、姜晶、謝瑞桃、郝文靜、鐘梅英)