氨氮是水環(huán)境中氮的主要形態(tài)之一[1],是引起水體富營養(yǎng)化和環(huán)境污染的一種重要物質.氨氮濃度過高會抑制自然硝化,引起水體缺氧,降低水體自凈能力[2].就目前來說,吸附法是去除氨氮最有效且廉價的方法之一,研究較多的吸附劑主要為沸石[3~5]、沉積物[6~8]、凹凸棒土[9]和植物材料[10]等.當前我國陶粒主要以黏土陶粒為主, 黏土原料的來源絕大部分取自于耕地, 是一條不符合我國國情的原料路線[11].污水處理過程中會產生大量剩余污泥,這些剩余污泥的處理處置費用已占到水處理總成本的50%~80%[12, 13].本課題組以自來水廠的混凝污泥為主要原料,開發(fā)出一種對磷元素具有良好吸附去除性能的新型過濾材料.發(fā)現除總磷外,濾料對污水中的氨氮也具有一定的去除性能.這可能與氨氮在濾料上的吸附作用有關,然而現有研究對上述過程發(fā)生的特點和原理的關注還較少.本研究通過制備工藝優(yōu)化強化了上述吸附材料的氨氮去除性能,系統(tǒng)評價上述過程發(fā)生的熱力學和動力學特征,初步提出了氨氮和新型吸附材料間的作用途徑,以期為污水中氮磷等營養(yǎng)元素的同步吸附去除提供理論支撐.
1 材料與方法
1.1 吸附劑的制備
本實驗制備吸附劑的主要原料為西安曲江水廠的混凝污泥,由于混凝污泥中本身含有天然的腐殖酸大分子有機物[14~16],在吸附劑的制作過程中人為加入了一定量的腐殖酸,目的是使腐殖酸在高溫下燒結過程中分解,增加吸附劑比表面積,且不會對處理水造成二次污染; 高嶺土具有一定的黏性,與混凝污泥混合燒結可使成品吸附劑易于成型.具體制作過程如下:①處理掉混凝物中的小固體雜物,在105℃的烘箱內烘干; ②上述混凝污泥中加入高嶺土和腐殖酸,控制混凝污泥∶高嶺土∶腐殖酸=10∶7∶2,調節(jié)含水率為60%~65%,混合均勻.人工制作成4~10 mm的球形顆粒; ③用馬弗爐(SX2-4-13)燒制成品陶粒吸附劑,將球形顆粒放入馬弗爐中,控制燒結溫度為700℃,時間為2 h,球形顆粒在馬弗爐中自然降溫到200℃左右時取出,待用.燒制好的成品球形吸附劑顆粒大小為2~4 mm.
1.2 靜態(tài)吸附實驗
本實驗采用靜態(tài)吸附法,主要考察了不同pH值、接觸時間、溫度對吸附實驗的影響,并進行了吸附等溫線、動力學和熱力學對吸附的影響研究.所有吸附實驗均重復3次,數據分析時取平均值,具體實驗如下:稱取若干份吸附劑樣品5.0 g,放入到一系列的50 mL比色管中,分別加入50 mL不同濃度的氨氮溶液.用1%的HNO3和1%的NaOH調節(jié)pH,將各樣品瓶置于恒溫培養(yǎng)箱中,在特定溫度下靜置24 h后,取上清液,過0.45μm的濾膜,采用納氏試劑比色法[17]測定氨氮含量,計算吸附容量[公式(1)]:
(1)
式中,ci為氨氮的初始濃度(mg·L-1); ce為氨氮的平衡濃度(mg·L-1); V為氨氮溶液體積(L); m為陶粒吸附劑的投加量(g).
1.3 吸附劑零點電荷pHzpc的測定
零點電荷pHzpc的測定方法[18]:量取50 mL濃度為0.01 mol·L-1的NaNO3溶液于一系列碘量瓶中,初調pH為2~11,平衡2 h后測溶液pH值,記為pHi; 然后向瓶中投入0.15 g陶粒吸附劑,用N2吹脫3~5 min后,在25℃、160 r·min-1下于恒溫振蕩箱內72 h,最后測定上清液pH值,記為pHf; 以pHi-pHf對pHi作圖,所得的曲線與橫坐標的交點即為pHzpc[圖 1(a)].當pH < pHzpc時,吸附劑表面帶正電荷,在庫侖力的作用下可以吸附陰離子; 當pH=pHzpc時,吸附劑表面凈電荷為零; 當pH > pHzpc時,吸附劑表面帶負電荷,會排斥陰離子.
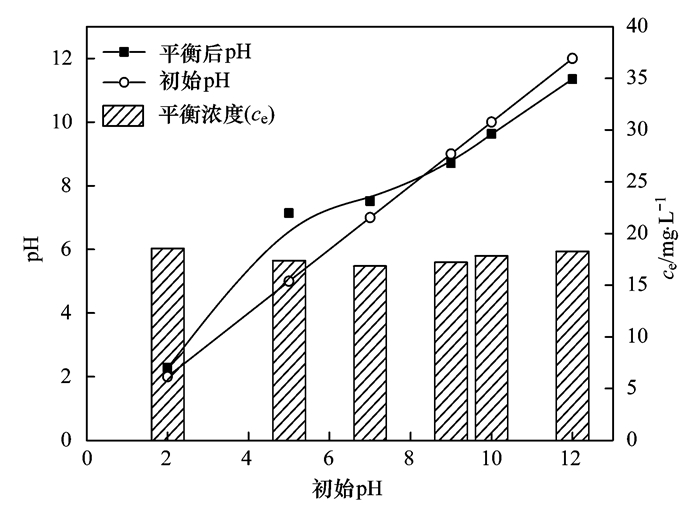
圖 1 陶粒吸附劑的pHzpc及不同pH下陶粒表面的Zeta電位
1.4 分析方法
采用傅里葉紅外(IRPrestige-21, 日本)觀察濾料的表觀形貌和物質組成,吸附劑表面的Zeta電位采用Zeta電位儀(ZS90,英國); 氨氮含量采用分光光度計(DR5000紫外分光光度計,美國)測定.
2 結果與討論
2.1 初始pH對氨氮吸附的影響
圖 2為不同pH下陶粒吸附劑對氨氮吸附效果的影響,可以看出,在酸性和中性條件下,隨著pH的升高,溶液中NH4+-N的平衡濃度逐漸降低; 而當溶液呈堿性時,隨著pH的繼續(xù)升高,吸附效果卻有下降趨勢.說明在中性條件下,對濾料對NH4+-N的吸附去除效果最好.這是因為酸性條件下溶液中H+濃度較大,可與濾料表面的≡MOH-OH發(fā)生中和反應,使濾料的有效吸附位點數量下降[19].同時,由于H+的離子半徑明顯小于NH4+,部分H+還將吸附在濾料表面,與NH4+存在競爭吸附作用[20, 5],不利于NH4+的去除.由圖 1(a)可知,吸附劑的pHzpc值在7.8左右.這意味著堿性條件下吸附劑表面將呈負電性[圖 1(b)].隨著溶液pH值的增加吸附劑表面的負電荷數量越多.而同時,水相中的游離NH4+將與OH-反應形成電中性的NH3·H2O,離子態(tài)的NH4+減少[21].這可能是堿性條件下NH4+的吸附量反而下降的主要原因.
(2)
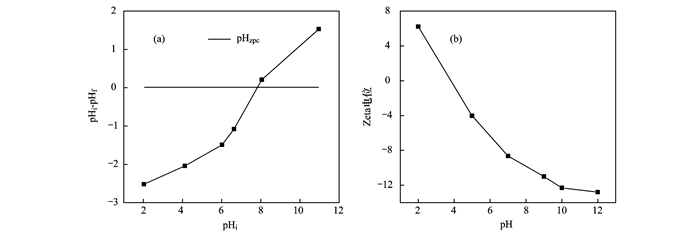
圖 2 pH對除氨氮效果的影響
氨氮吸附前后的傅里葉紅外光譜(FT-IR)見圖 3,其中3 600~3 000 cm-1的寬峰是結晶水的特征頻率區(qū); 1 680~1 630 cm-1范圍內一系列峰為C=O基的伸縮振動區(qū)域,在1 081 cm-1處出現C—H面內彎曲振動峰,而880~680 cm-1之間是由于苯環(huán)的C—H鍵面外彎曲振動吸收所致[22].氨氮吸附后的紅外光譜圖有偏移,如吸附前的3 451、1 638、1 081、779 cm-1,吸附后為3 450、1 637、1 055、777 cm-1,對應的化學鍵有O—H、C=O和C—H,說明這幾種可能和吸附有關或受吸附的影響[10].且1 504~1 550 cm-1處為N—H彎曲振動[23],圖 3中可以看出吸附后在1 510 cm-1處出現小峰,證明吸附后氨氮結合在吸附劑表面.
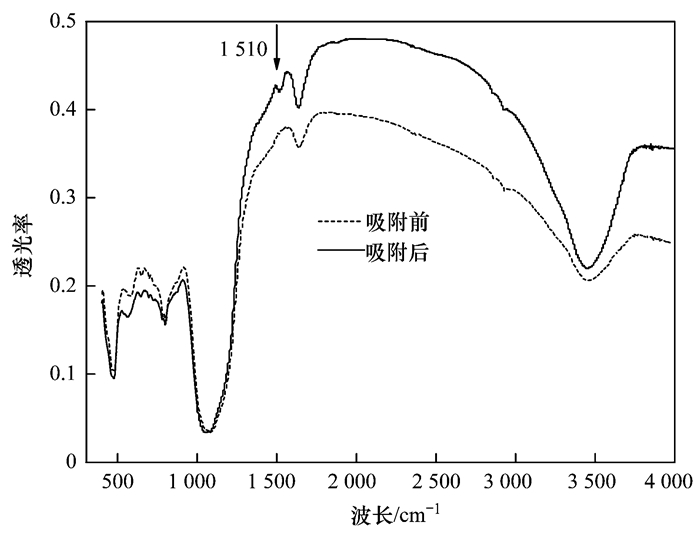
圖 3 氨氮吸附前后陶粒的傅里葉紅外光譜
2.2 吸附動力學
時間對吸附過程有很大的影響,在吸附過程中必須保證吸附劑與溶液有充分的接觸時間,才能使吸附劑發(fā)揮最大的吸附能力.從圖 4(a)中可看出,吸附基本可以分為3個階段,在0~1 h內,吸附劑對氨氮的吸附容量增加很快,從0.019 mg·g-1增至0.048 mg·g-1; 第2個階段為1~6 h, 吸附容量繼續(xù)增加,但與第1階段相比,吸附速率略有放緩趨勢; 6 h后吸附容量基本穩(wěn)定,吸附過程趨于平衡.這主要是由于開始時刻陶粒表面空的吸附點位較多,且溶液與陶粒表面液膜之間的濃度梯度較大,氨氮擴散速度較快,吸附過程也能很快進行,而后隨著吸附點位越來越少,擴散速度減慢,陶粒對氨氮的吸附放緩,最終達到吸附平衡.為了探討影響吸附的速率控制步是氨氮的擴散還是氨氮與陶粒表面結合的過程,需要對吸附過程進行準一級和準二級動力學擬合.
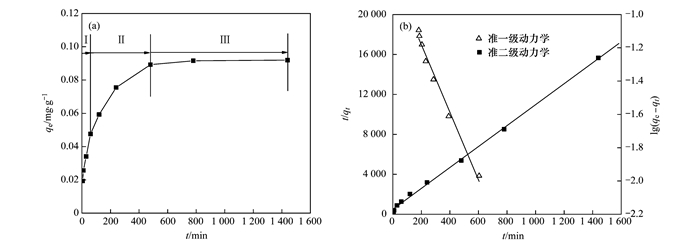
圖 4 時間對氨氮吸附效果的影響及準一級動力學和準二級動力學擬合
準一級動力學模型基于假定吸附受擴散步驟控制,吸附速率正比于qe與t時刻qt的差值.可以用公式(3)來描述準一級動力學模型:
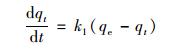
(3)
式中,qe為平衡吸附量; qt為t時刻平衡吸附量; k1為準一級吸附速率常數.
積分后:
(4)
以lg(qe-qt)對t作圖[圖 4(b)],根據斜率和截距可求得qe和k1的值(表 1),分析實驗數據是否符合準一級動力學.準二級動力學模型是基于假定吸附速率受化學吸附機制的控制,這種化學吸附涉及到吸附劑與吸附質之間的電子共用或電子轉移.可用下式表示:
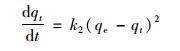
(5)
可簡化為:
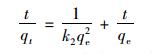
(6)

表 1 準一級動力學和準二級動力學參數
式中,k2為準二級吸附速率常數,其它參數同準一級動力學.通過t/qt對t作圖,如果吸附動力學符合準二級動力學,可得到一條直線[圖 4(b)].根據直線的斜率和截距,可得到qe和k2的值.由表 1擬合結果可得出相關系數大小關系:準二級動力學模型(R2=0.99) >準一級動力學模型(R2=0.98), 即相對于準一級動力學模型, 準二級動力學模型擬合最佳,能準確揭示吸附的整個過程.所以圖 4中陶粒的吸附過程可以很好地符合準二級動力學.
2.3 吸附熱力學
標準吉布斯自由能變化量(ΔGθ),標準反應焓變(ΔHθ),標準反應熵變(ΔSθ)與固-液分配系數KD之間的關系為[24]:
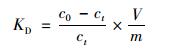
(7)
(8)
(9)
式中,c0為溶液中氨氮的初始濃度(mg·L-1),ct為t時刻溶液中氨氮濃度(mg·L-1),V為溶液體積(mL),m為陶粒吸附劑的投加量(g); R為理想氣體常數[kJ·(mol·K)-1]; T為絕對溫度(K).以ln(KD)對1 000/T作圖(圖 5),兩者呈線性關系,其斜率為-ΔHθ/R,截距為ΔSθ/R,求得ΔHθ和ΔSθ,代入到公式中,可得到ΔGθ.從表 2中可以看出ΔGθ為負值,說明吸附過程可以自發(fā)進行,隨著溫度升高,ΔGθ減少,說明高溫有利于吸附反應的進行.ΔHθ為正值,說明吸附NH4+為吸熱反應且吸附過程增加了固-液界面上物質的無序程度[5].已有研究表明[25]物理吸附的自由能變范圍為-20~0 kJ·mol-1,本實驗中的吸附劑對NH4+吸附的ΔGθ在-5.916~-3.176 kJ·mol-1之間,因此認為對NH4+的吸附可能為物理吸附.
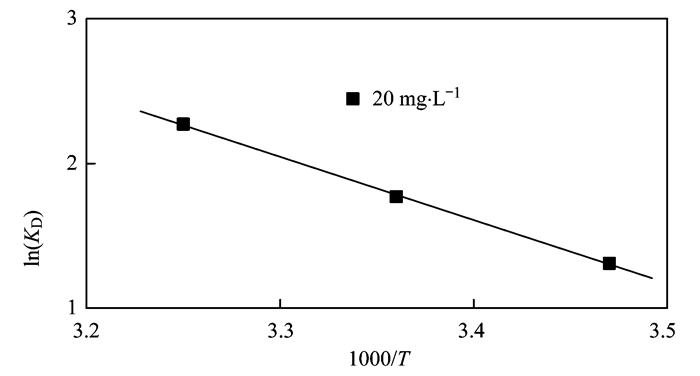
圖 5 陶粒吸附氨氮ln(KD)與1 000/T的關系
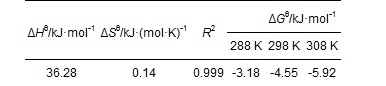
表 2 不同溫度下氨氮吸附的熱力學參數
平均吸附能E是判斷吸附類型的重要指標,可用式(10)來表達:
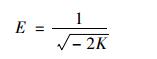
(10)
根據D-R模型的線性形式,以ln(qe)對ε2作直線,見圖 6,根據直線斜率可求得K.
(11)
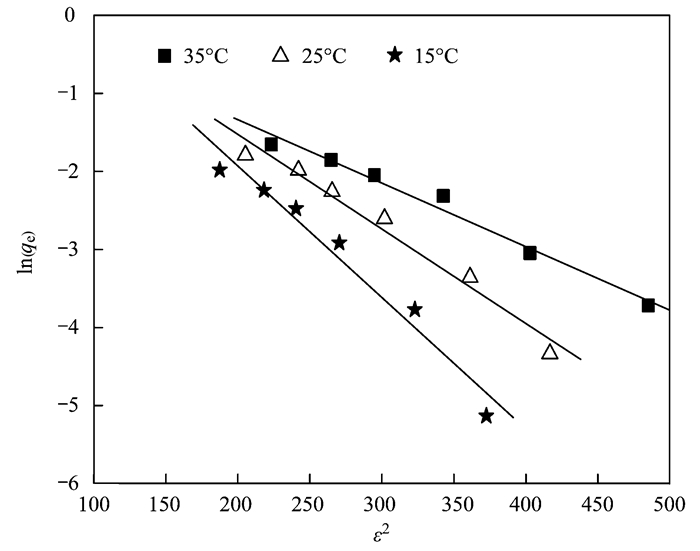
圖 6 ε2與ln(qe)的關系 Fig. 6 Plot ofε2 vs. ln(qe)
其中:
(12)
式中,E為平均吸附能(kJ·mol-1); K為與吸附能有關的常數,ε為Polanyi勢能(kJ),其余變量同前,ce的單位為mol·L-1.
由此可得到溫度在15、25、35℃下濾料對氨氮的平均吸附能E分別為7.84、6.43、5.45 kJ·mol-1.當1 kJ·mol-1
2.4 吸附等溫線
由于影響吸附性能的因素可能很復雜,因此須通過吸附等溫線實驗來確定.吸附等溫線是由吸附容量qe和平衡濃度ce的關系所繪出的曲線,由于熱力學結果證明陶粒對氨氮的吸附屬于物理吸附,所以進行Langmuir吸附等溫線擬合. Langmuir吸附等溫方程式:
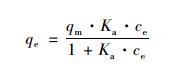
(13)
式中,qe為平衡時的吸附量(mg·g-1),ce為平衡時的溶液濃度(mg·L-1),qm是吸附劑飽和吸附量,Ka是Langmuir等溫吸附方程式常數(表 3).
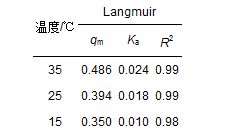
表 3 Langmuir吸附等溫線參數
等溫吸附實驗考察了3種溫度對氨氮吸附過程的影響.控制氨氮的初始濃度為5、10、20、30、40、60 mg·L-1,濾料投加量為100 g·L-1,接觸時間為24 h,在該條件下進行Langmuir吸附等溫線擬合.從圖 7中可以看出,濾料對氨氮的吸附大致可以分為2個階段:初始階段,隨著氨氮溶液濃度的增加,濾料對氨氮的吸附量增大,吸附等溫線比較陡直,當平衡濃度增大到一定程度后,吸附作用逐漸減弱,吸附等溫線趨于平緩. 圖 7中還可以看出,濾料對氨氮的吸附容量隨著溫度的升高而增加,Langmuir吸附等溫線可較好地擬合陶粒對氨氮的吸附效果(R2 > 0.99),說明吸附過程主要表現為單分子層吸附.具體參見污水寶商城資料或http://www.jianfeilema.cn更多相關技術文檔。
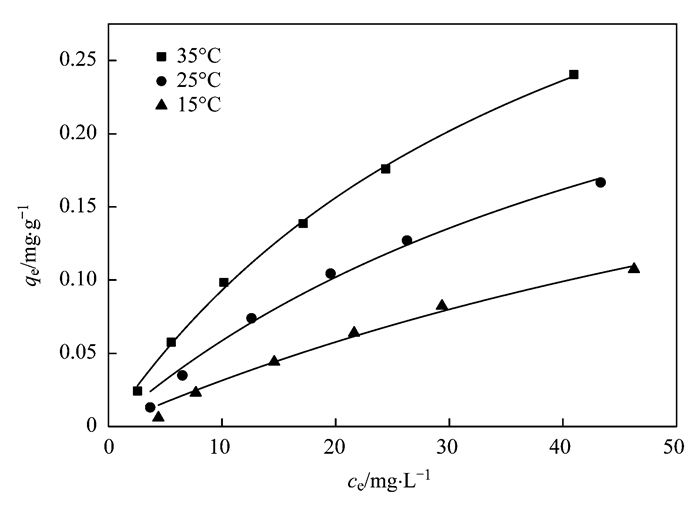
圖 7 Langmuir吸附等溫曲線
3 結論
給水廠混凝污泥制備的吸附劑對氨氮的吸附受pH的影響較大,在中性條件下,吸附效果最好. 6 h后吸附基本達到平衡,吸附過程遵循準二級動力學模型(R2 > 0.99).熱力學結果證明陶粒對氨氮的吸附屬于自發(fā)的吸熱反應且吸附屬于物理吸附,且溫度升高使平衡向吸熱的方向移動,所以溫度升高有利于吸附的進行. Langmuir吸附等溫模型能較好地描述陶粒對氨氮的吸附特征,說明對氨氮的吸附主要表現為單分子層吸附,吸附效果與比表面積和孔道的發(fā)達程度密切相關,在實際應用中如何使陶粒吸附劑發(fā)揮更大的作用,需對濾料進行改性,有必要進行進一步的分析研究.(來源及作者:西安建筑科技大學環(huán)境與市政工程學院 王文東、劉薈、張銀婷、楊生炯)


