污泥消化液含有高濃度NH4+-N和大量難降解有機物,是一種典型低COD/N廢水。目前污泥消化液常用處理方式是將上清液回流至主流工藝前端與市政污水混合處理,這將會使二級生物處理工藝進水氮負荷提高15%~25%,從而增加污水廠的處理成本和處理難度。
厭氧氨氧化(Anammox)作為一種新型脫氮工藝,與傳統工藝相比具有污泥產量少、曝氣能耗低、脫氮效率高等優點。以Anammox為核心的自養脫氮工藝已成功應用于污泥消化液的處理,但該工藝仍受限于厭氧氨氧化菌(AnAOB)易流失以及易受進水有機物影響等問題。目前的研究表明,有機物容易對Anammox系統的脫氮性能造成影響。Zhang等研究發現當進水COD為800mg/L(COD/N為4)時,氨氧化細菌(AOB)和AnAOB的活性與生物多樣性受到抑制,進而影響短程硝化-厭氧氨氧化(PNA)系統脫氮效果。然而也有研究表明低濃度有機物或低COD/N不會對Anammox系統的污染物去除造成影響。Chen等發現有機物濃度為10~30mg/L(COD/N<1)時,Anammox和反硝化互利共生,平均TN去除效果提高3.2%~7.7%。目前,關于有機物對Anammox系統影響的研究主要集中在成熟的Anammox活性污泥或生物膜系統中,鮮見進水COD對一體式泥膜復合短程硝化-厭氧氨氧化生物膜反應器(PNA-MBBR)掛膜啟動的研究。
因此,模擬青島某污水處理廠污泥消化液水質,探究進水COD(500mg/L,COD/N為1.25)對一體式泥膜復合PNA-MBBR系統掛膜啟動過程中脫氮性能以及絮體污泥和生物膜中微生物群落的影響,以期為研發以Anammox為核心的高氨氮、低COD/N廢水處理工藝提供理論基礎與技術支持。
1、材料與方法
1.1 試驗裝置
試驗在兩個有機玻璃制成的SBR反應器中進行。反應器內徑為18cm,有效高度為40cm,有效體積為10L;內部填充K3型載體,比表面積為500m2/m3,填充率為30%;反應器配有pH、DO以及溫度檢測探頭,內置電動攪拌器以確保流化效果。
1.2 接種污泥和進水水質
接種污泥取自青島市某污水處理廠好氧池,反應器MLSS設置為5000mg/L。試驗采用模擬廢水,NH4+-N為400mg/L,COD為500mg/L(CH3COONa∶C6H12O6=1∶1),KH2PO4為0.1mg/L,由NaHCO3提供堿度和無機碳源,微量元素Ⅰ和Ⅱ的投量均為1mL/L。COD只在R1進水中投加,R2用作對照。
1.3 試驗方法
R1和R2的排水比為50%。在反應器進水完成后,以間歇曝氣(攪拌∶曝氣=30min∶30min)模式運行,HRT視系統性能而定,為16~48h,運行溫度控制在(32±2)℃,pH控制在7.8左右。試驗共分為啟動、穩定運行、負荷提升三個階段,具體運行參數見表1。
1.4 分析方法
反應器進出水COD、NH4+-N、NO2--N、NO3--N濃度采用國家標準方法進行測定;pH、DO、溫度采用便攜式多參數分析儀(WTWMulti3620IDS)測定;生物膜厚度采用電子顯微鏡(OLYMPUSSZX10)進行觀察。
亞硝酸鹽積累率(NAR)和氮去除負荷(NRR)根據進出水NO2--N、NO3--N、TIN濃度等經計算得到;同步亞硝化-厭氧氨氧化-反硝化系統的氮去除計算方法參照文獻。
1.5 16SrRNA高通量測序
1.5.1 樣品采集與保存
采集各階段末期的絮體污泥和生物膜樣品,于-20℃冰箱保存。絮體污泥和生物膜樣品分別用字母S和B表示,數字1、2、3代表R1和R2的三個不同階段,如S1-1為R1第一階段結束時的絮體污泥樣品。
1.5.2 IlluminaMiSeq測序
使用FastDNA®SpinKitforSoil試劑盒進行樣品總DNA提取。利用引物338F(5'-ACTCCTAC GGGAGGCAGCAG-3')和806R(5'-GGACTACH VGGGTWTCTAAT-3')對細菌16SrRNA基因V3-V4區進行PCR擴增。PCR產物經回收、定量檢測之后,于MiSeqPE300平臺上進行高通量測序。經降噪處理后,利用UPARSE軟件,按97%的相似度對高質量序列進行操作分類單元(OTU)聚類,利用RDPClassifier對每條序列進行物種分類。
2、結果與討論
2.1 COD對氮去除的影響
2.1.1 氮去除特性
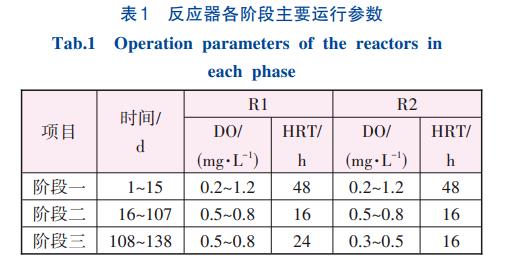
R1和R2各階段進出水氮濃度的變化見圖1。
在第一階段前期(1~7d),R1和R2出水NH4+-N濃度較高,平均濃度分別為140.52和199.23mg/L。出水NH4+-N濃度較高的原因可能是,運行前期采用低DO(0.2mg/L)運行模式,在抑制接種污泥中好氧異養菌代謝活性的同時,也影響了氨氧化微生物活性。在第8天將DO調高至1.2mg/L左右,出水NH4+-N濃度快速下降。在第一階段結束時,R1和R2出水NH4+-N濃度分別為0.43和5.45mg/L。被降解的NH4+-N大多轉化為NO3--N,R1和R2出水NO3--N濃度分別為229.90和235.55mg/L,表明R1和R2中亞硝酸鹽氧化菌(NOB)的活性較高。
為抑制NOB活性和實現部分短程硝化,階段二采用間歇曝氣和低DO(0.5mg/L)的運行策略。在該階段,R1出水NH4+-N、NO2--N和NO3--N平均濃度分別為123.05、94.44和9.67mg/L,R2出水平均濃度分別為173.51、172.83和22.32mg/L。R1和R2在第二階段的平均NAR分別為94.11%和89.27%,表明NOB活性已被充分抑制。有研究表明,NOB的氧半飽和系數明顯高于AOB,在與AOB競爭DO時往往會處于劣勢地位,再加上NOB歷經缺氧到好氧環境的活性恢復較AOB滯后,因此缺/好氧交替環境能夠有效抑制NOB活性,進而保證部分短程硝化的穩定運行。在該階段,R1平均進出水TN分別為397.62、227.16mg/L,平均去除率為42.87%,其中Anammox途徑貢獻了90.15%的TN損失,而反硝化途徑僅去除9.85%的TN。R2的TN平均去除率為7.64%,僅為R1的17.82%。以上結果表明,低COD/N有助于提高PNA-MBBR系統的脫氮效率。呂永濤等發現當COD為50mg/L時,Anammox系統的總氮去除率比不加COD時提高了7.57%。盡管COD的存在有利于提高反硝化菌在與AnAOB競爭底物過程中的優勢,不利于Anammox活性的維持,但對于多種脫氮功能菌共存的一體式泥膜復合PNA-MBBR系統來說,反硝化菌可以利用進水COD作為電子供體,將系統中上周期殘留的NO2--N還原為氮氣,降低了系統中NO2--N的濃度(R1平均出水NO2--N濃度為R2的54.65%),進而緩解高濃度NO2--N對AnAOB的毒害作用,有利于提高系統的脫氮性能。
為進一步提高R1和R2的脫氮性能,第三階段運行期間分別對R1和R2進行延長HRT和降低DO濃度的調整。R1的TN平均損失和平均去除率分別為213.87mg/L和52.93%,較階段二分別提高了25.47%和23.47%。R2出水NH4+-N、NO2--N和NO3--N平均濃度分別為208.21、148.54和12.72mg/L,TN平均去除率(8.45%)較上一階段提高了10.60%。此時R1平均NRR為0.23kg/(m3·d),其中92.70%的TN損失通過Anammox途徑去除,R2平均NRR僅為0.06kg/(m3·d)。
2.1.2 COD去除特性
R1在各階段的出水COD平均濃度分別為41.56、41.74和42.13mg/L,平均去除率分別為91.73%、91.68%和91.69%,表明R1在不同階段均表現出良好的COD去除性能。鏡檢顯示,在第三階段結束時,R1和R2中生物膜平均厚度分別為(351.76±67.93)μm和(148.96±44.48)μm,表明COD的存在有助于填料迅速掛膜。較厚的生物膜可緩解DO對生物膜內層AnAOB的沖擊作用,有利于維持AnAOB的活性。R1和R2出水中均殘留有較高濃度的NO2--N,在經過0.5h缺氧攪拌后,R1中NO2--N濃度50mg/L(見圖2),表明在R1進水和前置缺氧0.5h過程中,COD可作為反硝化的電子供體,用于去除系統中殘留的NO2--N。
此外,在間歇曝氣過程中,COD濃度呈逐步降低趨勢,且R1在階段二和階段三的出水NO3--N平均濃度分別為9.67和10.19mg/L,低于Anammox理論NO3--N產量(20.07和25.02mg/L),說明在間歇曝氣過程中,存在NO3--N的還原。因此,進水中的COD不僅有利于PNA-MBBR系統快速掛膜,還可有效去除殘余的NO2--N和Anammox產生的NO3--N,降低NO2--N的不利影響,有助于PNA-MBBR系統的啟動和深度脫氮。
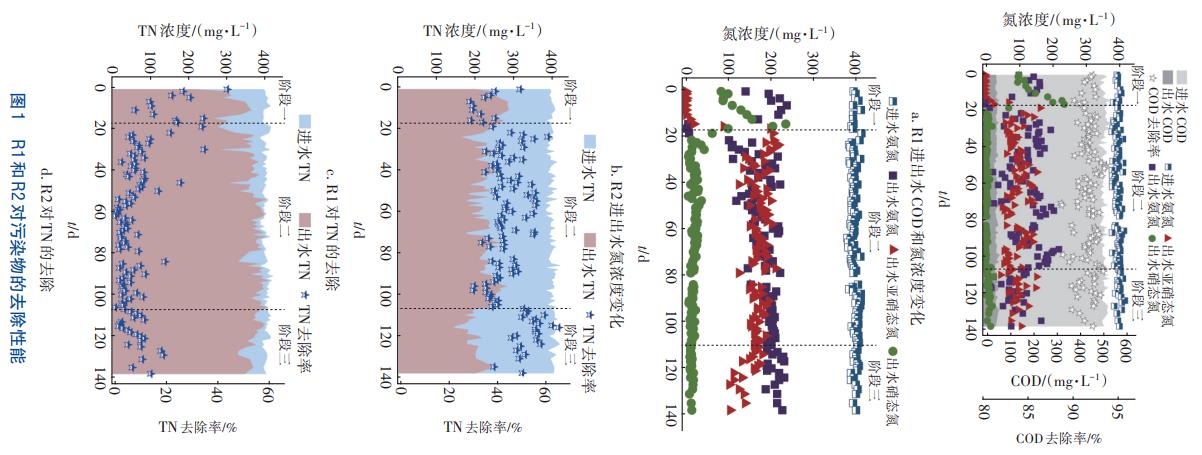
2.1.3 R1和R2典型周期的氮素轉化規律
為進一步研究COD對系統脫氮的影響,對R1和R2在第二和第三階段末期的典型周期進行分析,結果見圖2。對于階段二,經過0.5h缺氧攪拌后,R1和R2中NO2--N濃度分別為1.17、107.90mg/L。在R1中,NH4+-N濃度從混合后的241.6mg/L減少至80.75mg/L,出水NO2--N和NO3--N濃度分別為100.59、1.21mg/L,TN去除率為54.90%。在R2典型周期中,隨著NH4+-N降至118.73mg/L,NO2--N濃度由107.90mg/L逐步增至200.98mg/L,遠超R1出水NO2--N濃度;此時,出水NO3--N濃度和NAR分別為36.23mg/L和84.73%,TN去除率僅為11.93%。有研究表明,NO2--N作為一種解偶聯劑會增加細胞膜的滲透性,影響胞內電子傳遞和質子轉移相關的酶,進而對ATP的合成產生抑制作用,從而降低AOB和Anammox菌的活性。R2出水NO2--N濃度遠超其對Anammox菌的抑制閾值100mg/L,推測這是其脫氮性能受到抑制的主要原因。
在階段三,R1出水NO2--N濃度為20.01mg/L,與階段二相比大幅度降低;在周期結束時出水COD、NH4+-N和NO3--N濃度分別為45.00、119.96和1.54mg/L,TN去除率由階段二的54.90%增加至65.19%。R2出水NH4+-N、NO2--N和NO3--N濃度分別為227.36、100.44和13.83mg/L,其中出水NO2--N濃度較階段二明顯下降;此時R2的NRR為0.10kg/(m3·d),較階段二提高了12.62%。
2.2 微生物群落結構分析
2.2.1 微生物多樣性分析
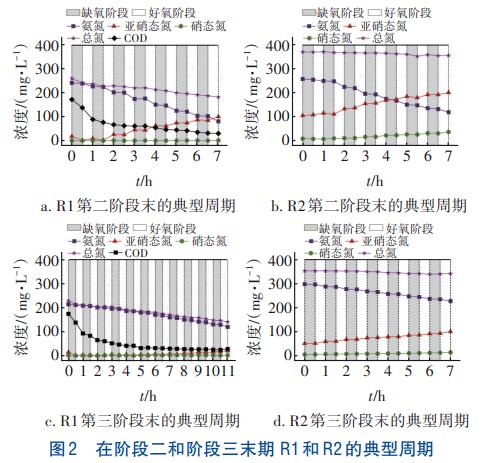
R1和R2不同階段絮體污泥和生物膜樣品的微生物多樣性如圖3(a)所示。R1和R2絮體污泥樣品的Shannon指數均為先上升后下降,在第二階段達到了最大值。R1生物膜樣品的Shannon指數一直上升,在第三階段達到了最大值,但仍低于R2生物膜樣品的多樣性。圖3(b)展示了R1和R2絮體污泥和生物膜樣品中OTU(數量分別為416、443、570、751)的差異性。4組樣品中共有的OTU為239,僅占總OTU(2180)的11%,說明R1和R2兩個反應器中微生物群落結構發生明顯的變化。無論是絮體污泥還是生物膜樣品,R2的總OTU均高于R1。
2.2.2 門水平微生物群落結構分析
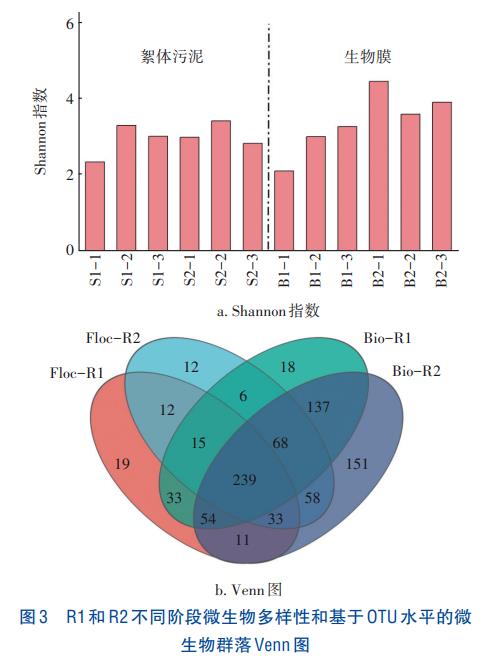
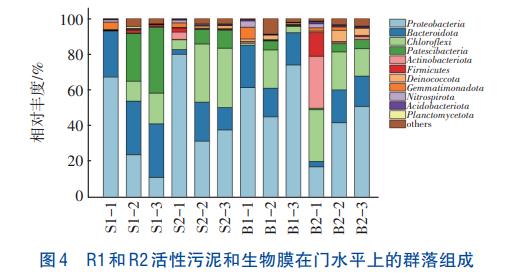
R1和R2絮體污泥和生物膜樣品在門水平上的微生物群落結構見圖4。Proteobacteria、Bacteroidota和Chloroflexi是所有樣品中的優勢菌門,與已報道的PNA系統微生物群落結構相似。Proteobacteria的相對豐度在R1和R2中呈現不同的變化規律。無論是在R1絮體污泥樣品還是在生物膜樣品中,Proteobacteria的相對豐度均呈下降趨勢,分別從S1-1、B1-1的67.26%和79.97%下降至S1-3、B1-3的11.16%和37.67%,而在R2中則表現出與R1相反的變化規律,分別從S2-1、B2-1的61.30%和17.06%上升至S2-3、B2-3的74.05%和50.78%。Bacteroidota在R1和R2絮體污泥樣品中的相對豐度變化不明顯,但隨著反應器運行,其在生物膜樣品中的相對豐度有所增加,在B1-3和B2-3樣品中的相對豐度分別為12.56%和17.01%。Chloroflexi在R1和R2生物膜樣品中的平均相對豐度(23.77%和21.84%)均高于其在絮體污泥樣品中的平均相對豐度(9.53%和8.69%)。目前已報道的AnAOB均屬于Planctomycetota,其在B1-3和B2-3的相對豐度分別為0.42%和0.13%,均高于同時期在絮體污泥樣品中的相對豐度(0.16%和0.05%),且其在R1階段二和階段三樣品中的平均豐度為0.53%,高于R2中的0.21%。
2.2.3 屬水平微生物群落結構分析
為進一步探究COD對脫氮功能微生物群落結構的影響,對R1和R2絮體污泥和生物膜樣品的硝化菌屬、Anammox菌屬和反硝化菌屬進行分析,結果見圖5。Nitrosomonas是R1和R2中主要的AOB菌屬。在R1絮體污泥和生物膜樣品中,Nitrosomonas的相對豐度均呈下降趨勢,從S1-1、B1-1的3.61%和1.15%分別下降至S1-3、B1-3的2.64%和0.42%。而在R2中,Nitrosomonas的相對豐度從S2-1、B2-1的13.94%和3.67%分別增長至S2-3、B2-3的37.81%和13.91%。在R1和R2中均是絮體污泥樣品的Nitrosomonas平均豐度(3.28%和21.25%)大于生物膜樣品的平均豐度(0.69%和10.53%),這可能是由于AOB在填料生態位競爭中處于劣勢所導致,王智輝在泥膜復合PNA系統啟動研究中發現了同樣現象。Nitrospira和Nitrolance為NOB菌屬,只在第一階段檢測到。隨著反應器運行,NOB逐漸被淘洗出系統,這與R1和R2在階段二和階段三表現出較好的短程硝化效果相對應。
在高通量測序中,沒有在屬水平檢測到Anammox相關菌屬序列,可能是R1和R2中AnAOB豐度較低和高通量測序靈敏度不足所致,Wang等也報道了類似情況。此外,SM1A02菌屬屬于Planctomycetes菌門,與AnAOB密切相關,在一些研究中被認為是“潛在的新型AnAOB”。因此,分析了SM1A02菌屬在各樣品中的變化。由圖5(b)可知,SM1A02在R1和R2絮體污泥樣品中的相對豐度相當,分別為0.04%和0.03%。但SM1A02在R1生物膜樣品中的相對豐度遠高于R2,尤其在階段二和三中,其在R1中的相對豐度分別為0.33%和0.28%,而在R2中僅為0.08%和0.06%,說明載體生物膜有利于持留AnAOB這類生長緩慢的微生物,且低COD/N條件有利于其富集生長,為氮的穩定去除提供保障。
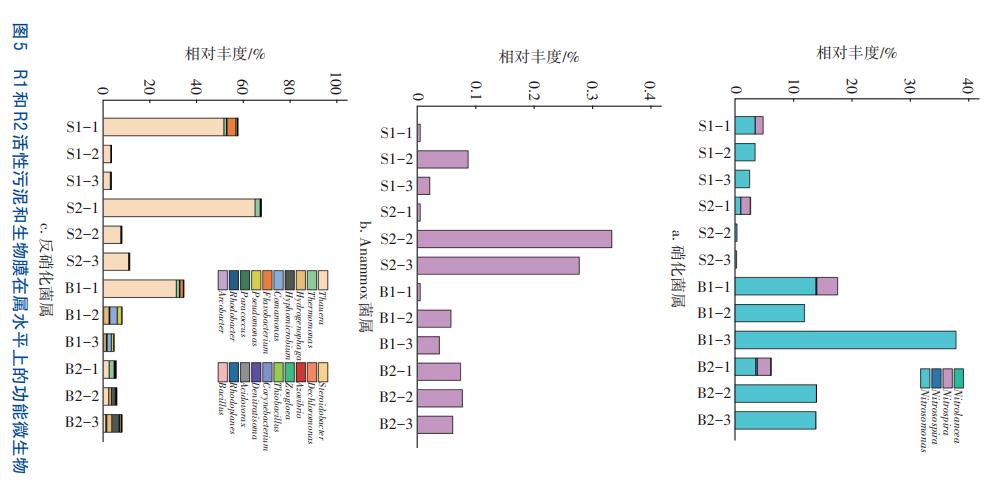
R1和R2分別檢測出9種和17種反硝化菌屬,且Thauera的平均相對豐度最高,其在R1和R2中分別占總反硝化菌屬的93.31%和58.28%,這與其他文獻中結果類似。對于R1的絮體污泥和生物膜樣品,Thauera的相對豐度分別從S1-1、B1-1的52.01%和65.29%下降至S1-3、B1-3的3.52%和11.27%,在R2中的相對豐度則從S2-1、B2-1的31.71%和3.03%下降至S2-3、B2-3的0.53%和1.56%。值得注意的是,R1中Thauera在反硝化菌屬中始終占據主導地位,而Hydrogenophaga、Hyphomicrobium和Comamonas等在R2中反硝化菌的占比有所上升。有研究表明,當分別以葡糖糖和乙酸鈉為碳源時,系統中的優勢反硝化菌屬均為Thauera,其相對豐度分別高達58.69%和70.62%。因此,推測R1進水中的葡萄糖和乙酸鈉有利于Thauera的專屬富集,使其成為R1中的絕對優勢反硝化菌屬,進而降低R1反硝化菌屬多樣性。
2.2.4 屬水平上差異物種分析
為研究R1和R2中絮體污泥和生物膜的微生物種群結構差異,在屬水平對R1和R2第二、三階段的絮體污泥和生物膜樣品進行差異分析。結果表明,R1和R2總微生物群落共有28個菌屬存在顯著差異,其中在R1中僅有8個菌屬的豐度顯著高于R2,而R2顯著富集了20個菌屬。如Thauera菌屬在R1中的相對豐度是R2的4.8倍,OLB8、Dokdonella和Hydrogenophaga等菌屬在R2中的相對豐度遠高于R1。分別對比R1和R2的絮體污泥群落以及生物膜群落發現,無論是絮體污泥還是生物膜,均是R2中顯著富集的菌屬多于R1,這與總微生物群落分布相對應。Arenibacter、Paludibaculum和Aeromonas等菌屬在R1絮體污泥中的相對豐度較高,而R2絮體污泥中富集的菌屬為Hyphomicrobium、Bosea和Rhodobacter等。對于生物膜樣品,R1中富集的菌屬均與脫氮密切相關,分別為Defluviicoccus、SM1A02、OLB13和Thauera,其中Defluviicoccus作為一種常見的聚糖菌(GAOs),具有內碳源反硝化作用。研究表明GAOs偏好于以乙酸作為碳源,R1進水中的乙酸鹽可能是Defluviicoccus得以富集的主要原因。宏基因組學研究表明,OLB13含有編碼呼吸氨化、NO2--N解毒以及CO2固定途徑所需關鍵酶的基因,這些途徑可與AnAOB相互作用,進而有助于AnAOB在R1中生長。此外,OLB13還具有短程反硝化作用。Nitrosomonas在R2生物膜樣品中被顯著富集。對比同一反應器中絮體污泥樣品和生物膜樣品可以發現,均是生物膜中顯著富集的菌屬數量高于絮體污泥,這得益于填料上分層的生物膜結構,可為多種微生物提供合適的生存環境。
3、結論
①R1進水中的有機物可有效降低系統NO2--N濃度和促進填料快速掛膜,有助于PNA-MBBR工藝的啟動。
②R1和R2在負荷提升階段的平均總氮損失分別為0.23、0.06kg/(m3·d)。R1中Anammox和反硝化兩種脫氮途徑對總氮的去除貢獻分別為92.70%和7.30%。
③一體式泥膜復合PNA-MBBR系統中的優勢AOB為Nitrosomonas,主要分布在絮體污泥中,SM1A02主要分布在填料生物膜中,且其在R1生物膜樣品中的相對豐度遠高于同時期R2生物膜樣品。Thauera是R1絮體污泥和生物膜中具有絕對優勢的反硝化菌屬。
④R2中總微生物群落多樣性高于R1。R1和R2中的生物膜顯著富集菌屬數量高于絮體污泥。(來源:青島理工大學環境與市政工程學院,青島理工大學城鎮污水處理與資源化國家地方聯合工程中心,青島市水務事業發展服務中心,青島首創瑞海水務有限公司)



