厭氧氨氧化(anaerobicammoniumoxidation,Anammox)可以代替傳統硝化反硝化工藝去除污水中的氮,具有能耗低、產泥量少、無需外加碳源和運行成本低等優勢,被認為是最有前途的生物脫氮工藝之一。由于厭氧氨氧化生長緩慢,倍增時間長,工程上采用生物膜或顆粒污泥形態持留厭氧氨氧化菌(anaerobicammoniumoxidationbacteria,AnAOB),以保證系統穩定運行。目前,厭氧氨氧化工藝已成功應用于污泥厭氧消化上清液等高濃度氨氮污水處理中。由于城市污水具有氨氮濃度低、溫度低等特點,限制了厭氧氨氧化的主流應用。為提高AnAOB活性,通常采用投加FeS、Fe(Ⅲ)、納米零價鐵(nZVI)、羥胺(NH2OH)、肼(N2H4)、石墨烯以及生物炭等輔助材料。其中,N2H4作為厭氧氨氧化代謝中間產物受到廣泛關注。N2H4可以通過抑制其他細菌生長,降低與AnAOB對底物的競爭,同時為AnAOB的生長提供額外能量,減少NO3--N的產生,從而提高厭氧氨氧化反應器脫氮性能。
YAO等研究表明,當加入3.99mg·L-1的N2H4時,CANON系統中顆粒污泥的厭氧氨氧化活性增加,當N2H4質量濃度為4.86mg·L-1時,可以緩解NO2--N對AnAOB活性的抑制。MIODOŃSKI等添加了3.7mg·L-1的N2H4后,在高基質濃度條件下厭氧氨氧化系統在42d內完成了快速啟動,平均氮負荷率(nitrogenloadingrate,NLR)比對照組高2倍。蔡慶等通過批式實驗研究N2H4對高基質濃度下(NH4+-N約225mg·L-1,NO2--N約280mg·L-1)厭氧氨氧化顆粒污泥的短期影響,結果發現,當N2H4質量濃度在1.8~9.5mg·L-1時,厭氧氨氧化活性明顯增加。XIANG等研究發現當N2H4質量濃度為2~5mg·L-1時,純顆粒污泥和絮體-顆粒混合污泥的反應器均可保持長達4個月的穩定高效運行,但純顆粒污泥系統具有更高效的性能,總氮去除速率(totalnitrogenremovalrate,TNRR)達到(0.33±0.04)g·(L·d)-1。可見,N2H4對AnAOB活性的影響不僅與N2H4質量濃度有關,還與污泥形態有關。目前大部分研究集中于N2H4對顆粒形態AnAOB的影響,而低質量濃度N2H4對生物膜形態厭氧氨氧化體系的研究尚有不足。但在城市污水低氨氮濃度條件下,厭氧氨氧化顆粒污泥粒徑小,難以有效持留在系統中,而通過載體形成的厭氧氨氧化生物膜可被有效截留于反應器中,因此,生物膜形式的厭氧氨氧化技術具有更廣泛的應用。懸浮載體上的生物膜可自發富集AnAOB,加速AnAOB的粘附與生長,從而加速主流厭氧氨氧化工藝性能的提升。由于生物膜傳氧限制,厭氧氨氧化生物膜可以在低溶解氧(dissolvedoxygen,DO)環境下生長,對正常的北方氣候溫度和低氨氮底物濃度適應良好。因此,探究低質量濃度N2H4對厭氧氨氧化生物膜的長期影響,可以為厭氧氨氧化的在城市污水脫氮中的應用提供技術支撐。
1、材料與方法
1.1 實驗裝置
實驗室規模的小試采用3個圓柱形移動床生物膜反應器,有效容積為2L。R1為對照組,R2和R3中分別添加5mg·L-1和10mg·L-1的N2H4。3個反應器中均填充已掛膜的填料,填充比為35%,填料直徑為25mm,高10mm。采用序批式活性污泥法(sequencingbatchreactoractivatedsludgeprocess,SBR)運行,周期為6h(360min),包括5min進水,340min攪拌,14min沉降和1min排水,HRT為1d,日處理量為2L·d-1。3個反應器均在常溫條件下運行,溫度在(27.6±2.4)℃。反應器裝置如圖1所示。
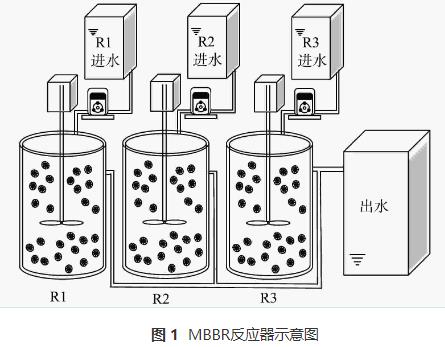
1.2 生物膜與模擬廢水
實驗中用到的生物膜污泥來自實驗室穩定運行196d的移動床生物膜反應器(movingbedbiofilmreactor,MBBR),NLR為0.6kg·(m3·d)-1,生物膜系統中的污泥質量濃度為(1800±100)mg·L-1。
實驗采用模擬廢水,主要成分有50mg·L-1 NH4+-N、55mg·L-1 NO2--N、300mg·L-1 CaCl2·2H2O、180mg·L-1 MgSO4·7H2O、27.2mg·L-1 KH2PO4以及500mg·L-1 NaHCO3。每升廢水分別加入1mL微量元素Ⅰ和Ⅱ。N2H4以N2H4·H2SO4的形式投加。初始pH通過滴加1mol·L-1的HCl或NaOH溶液調節到6.9~7.3。配水采用自來水,未對其進行脫氧處理,進水DO質量濃度為5mg·L-1。
1.3 實驗設計
整個過程按不同運行參數分為3階段。階段Ⅰ(1~11d):為獲取較為穩定的實驗條件,反應器在初始NLR下運行。階段Ⅱ(12~46d):加入N2H4運行,3個反應器N2H4質量濃度分別為0、5、10mg·L-1。階段Ⅲ(47~60d):停止加入N2H4,反應器繼續運行。實驗設計如表1所示。

1.4 分析方法
用比色法測定NH4+-N、NO2--N、NO3--N和N2H4的質量濃度。其中NH4+-N、NO2--N和NO3--N采用標準測試方法。通過加入1mol·L-1 HCl和0.1mol·L-1 KIO3溶液消除N2H4對NH4+-N測定的干擾。N2H4依照Watt和Chrisp的檢測方法,通過加入0.5%的氨基磺酸溶液消除NO2--N對N2H4測定的干擾。在每個階段結束(反應器運行第11、46和60天)留取生物樣品測定生物量(suspendedsolids,SS)、有機物量(volatilesuspendedsolids,VSS)、胞外聚合物(extracellularpolymericsubstances,EPS)、血紅素和微生物群落結構。
采用水解法提取生物膜樣品中的EPS(主要由蛋白質和多糖組成),蛋白質(proteins,PN)用改良Folin-Lowry法測定,使用牛血清蛋白作為標準物質。多糖(polysaccharides,PS)用蒽酮-硫酸法測定,使用葡萄糖作為標準物質。EPS濃度以單位質量揮發性有機物中EPS的質量(mg·g-1)表示。
用磷酸鹽緩沖液(PBS)通過細胞破碎的方式提取血紅素,以氯化血紅素作為標準物質,通過Pyridine-NaOH方法測定血紅素的含量。血紅素濃度以單位質量揮發性有機物中血紅素的物質的量(μmol·g-1)表示。
1.5 計算方法
為直觀表示出整個反應體系中的主導反應,依照亞硝化反應(式(1))、硝化反應(式(2))以及厭氧氨氧化反應(式(3))的化學計量方程計算得到含有NH4+-N、NO2--N、NO3--N變化量的公式。在進水無有機物的厭氧氨氧化反應器中,異養生物對NRR的貢獻通常<5%,可忽略其對整體反應的影響,故在計算時不考慮反硝化過程,計算得到式(4)~式(7)。
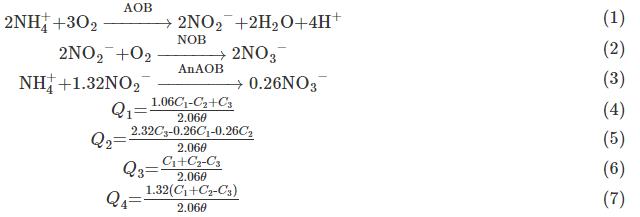
式中:θ為周期時間,d;C1,C2為1個周期內NH4+-N和NO2--N的去除量,mg·L-1;C3為NO3--N的生成量,mg·L-1。Q1為AOB對NH4+-N的氧化速率(AOR),g·(m3·d)-1;Q2為NOB對NO2--N的消耗速率(NOR),g·(m3·d)-1。Q3 為AnAOB對NH4+-N的消耗速率(AnAOR),g·(m3·d)-1;Q4為AnAOB對NO2--N的消耗速率(AnANR),g·(m3·d)-1。
1.6 微生物群落結構分析
在各階段的穩定運行期內,保留生物膜樣品于-80℃條件下凍存。實驗結束后統一進行基因組DNA的提取,之后采用341F(5’-CCTACGGGNGGCWG-CAG-3’)和785R(5’-GACTACHVGGGTATCTAATCC-3’)作為擴增引物,對細菌16SrRNA基因進行2輪PCR擴增。后續使用IlluminaNovaseq6000測序平臺進行高通量并行測序,將相似水平在97%的序列歸為1個OTU進行生物信息統計分析。
2、結果與討論
2.1 N2H4對總氮去除率的影響
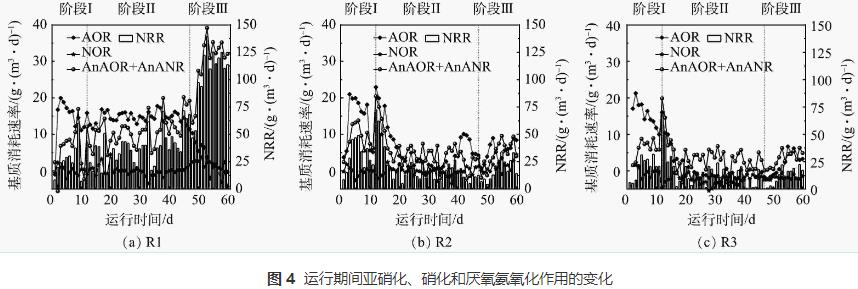
反應器各階段運行性能如圖2所示。在進水NH4+-N和NO2--N質量濃度分別為(50.9±3.6)mg·L-1和(55.5±3.2)mg·L-1條件下持續運行11d后,3個反應器運行趨于平穩。階段Ⅰ結束時NRR分別為27.7、24.7、23.2g·(m3·d)-1,這一差異可能是由于實驗前期選取的生物膜填料掛膜不均勻導致。
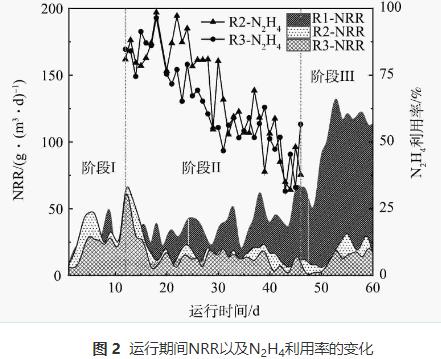
對照組R1內逐漸形成穩定的厭氧氨氧化環境,階段III時NRR最高達到139.2g·(m3·d)-1。R2和R3在加入N2H4后均表現出NRR先快速上升后下降的趨勢。階段Ⅱ運行前期(第12~15天),R2和R3中的NRR分別提升了74%和44%,此時N2H4的利用率均在74%以上。隨著運行周期的增加(第16~46天),R2和R3的脫氮效能逐漸下降,其中R2內NRR下降了53%,R3內NRR下降了64%,在階段Ⅱ結束時(第46天)R2和R3中N2H4的利用率分別從最高值(97%和79%)下降到32%。當R2和R3系統內的脫氮效能低于15g·(m3·d)-1時停止加N2H4,開始階段Ⅲ的運行。N2H4的抑制解除后,R2內厭氧氨氧化活性開始逐漸恢復,到階段Ⅲ末期,NRR由階段Ⅱ末期的11.0g·(m3·d)-1升至到33.4g·(m3·d)-1,R3的NRR也由10.4g·(m3·d)-1升至22.8g·(m3·d)-1,表明停止投加N2H4后,其抑制作用可緩慢恢復。經14d恢復后,R2反應器的脫氮效能恢復到投加N2H4前的水平,然而,10mg·L-1的N2H4對生物膜的抑制作用更強,生物膜恢復更加緩慢。SCHALK等(N2H4投加量為28.8mg·L-1)的研究結果也證實了這一點。但GANESAN等(N2H4投加量為10mg·L-1)、ZHOU等(N2H4投加量為10mg·L-1)、MIODOŃSKI等 (N2H4投加量為3.7mg·L-1)和XIANG等(N2H4投加量為2~5mg·L-1)的研究結果均表明,投加不同質量濃度的N2H4均能維持脫氮系統長期運行且N2H4可被快速消耗,這與本研究的結果并不一致。
本研究中出現N2H4濃度不斷積累且NRR不斷下降的現象,推測可能有以下2點原因。一方面,生物膜與顆粒污泥的形態結構存在差異。對比本研究中使用的生物膜,顆粒污泥結構更加密實,傳質效率低,內部更容易形成較強的濃度梯度,即實際進入顆粒污泥內部的N2H4濃度會低于水中測得的濃度。溶質的濃度梯度是隨著生物膜厚度的增加而形成的,生物膜厚度會影響液體的流動擴散和營養物質的傳質效果,從而影響工藝整體性能。本研究中生物膜厚度較薄(約550μm),可推測擴散到生物膜內部的N2H4質量濃度較高,從而對AnAOB產生較強的毒性效應。另一方面,基質的質量濃度和N2H4質量濃度的比例不同。在前人研究N2H4對低基質(TN<100mg·L-1)厭氧氨氧化系統的長期影響中,維持系統良好脫氮效果的基質質量濃度與N2H4質量濃度的比例在10左右。本實驗中R2和R3中此比例分別為21和10.5,但顯然R3受到更強的抑制作用,很可能是N2H4擴散到生物膜的速度過快,因此,需要降低N2H4的質量濃度以達到更好的TN去除效果。根據STROUS提出的厭氧氨氧化分解代謝模型,可推知未反應完全的N2H4會促使反應逆向進行從而產生NH4+-N。SCHALK等在加入N2H4的厭氧氨氧化批式實驗中觀察到,1mol的N2H4可被轉化為1.3mol的NH4+-N,在ZEKKER等的實驗中,1mol的N2H4可形成1.63molNH4+-N。可見,AnAOB對N2H4有歧化作用,高質量濃度的N2H4會導致NH4+-N不斷積累而升高,從而NRR也不斷下降。
2.2 N2H4對生物量的影響
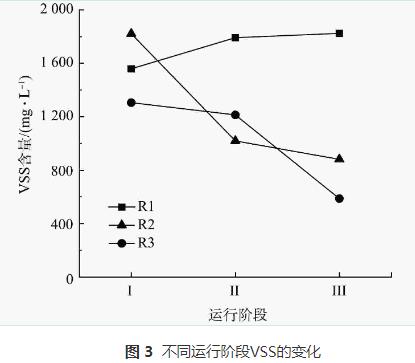
整個運行期間3個反應器內生物量變化如圖3所示。對照組R1中的生物量隨運行時間的增加逐漸升高,在整個實驗周期結束時VSS達到1824mg·L-1。且R1在3個反應器中表現出最好的脫氮性能,也證實了R1內生物膜活性較高的結論。在階段Ⅱ中,R2和R3中均出現了污泥流失情況。停止加入N2H4后,2個反應器內污泥量仍持續下降。R2在階段Ⅱ和階段Ⅲ結束時的VSS分別為1019mg·L-1和880mg·L-1,R3在階段Ⅱ和階段Ⅲ內VSS分別為1213mg·L-1和587mg·L-1。對比初始值,階段Ⅲ結束時R2的VSS濃度下降了52%,R3內的VSS濃度下降了55%,可以看出,加入N2H4后反應器內部生物膜會逐漸脫落和流失,生物膜活性減弱,導致系統內部的脫氮效能下降。
2.3 N2H4對各反應過程的影響
由于進水中含有一定溶解氧,促進了脫氮系統中硝化菌的生長。為評估系統中亞硝化,硝化和厭氧氨氧化效果,對反應器中各階段的氮素變化量進行分析,從而得到各個反應體系中氨氧化菌(ammonia-oxidizingbacteria,AOB)、亞硝酸鹽氧化菌(nitrite-oxidizingbacteria,NOB)和AnAOB的變化趨勢,結果如圖4所示。從圖4(a)可以看出,在階段Ⅰ和階段Ⅱ,R1中的AOB和NOB均維持在穩定狀態,AnAOB活性逐漸升高,階段Ⅱ結束時提高了約80%。但在階段Ⅲ開始時AOB作用減弱,NOB和AnAOB作用增強,NRR最高可達139.2g·(m3·d)-1。R2以及R3內基質消耗速率分別見圖4(b)和圖4(c)。加入N2H4后2個反應器內AOR、AnAOR和AnANR短暫提升,與NRR變化規律相一致,說明N2H4的投加會在短期內迅速提高厭氧氨氧化生物膜系統的脫氮效能。有研究表明,外源N2H4可以直接被AnAOB利用,促進厭氧氨氧化進程。對本研究中的厭氧氨氧化生物膜來說,N2H4添加量為5mg·L-1時的脫氮效果優于10mg·L-1。對比對照組R1,R2和R3系統內的AnAOB和AOB的活性均只在加入N2H4的前4d得到提升,但很快就下降到較低水平,與NRR的變化規律一致。這可能是由于N2H4的長期抑制作用導致反應器內生物量隨著生物膜不斷脫落而流失(SS分別為6194mg·L-1和4322mg·L-1),因此,反應器內功能菌的數量進一步降低。階段Ⅱ運行后期(第31~46天)R2和R3出水N2H4質量濃度分別穩定在1~3mg·L-1和3~5mg·L-1,推測在此階段N2H4的投加量超過AnAOB的利用量,AnAOB不能有效降解N2H4,繼續添加會導致N2H4逐漸積累從而抑制AnAOB的活性。由于N2H4對AOB和NOB均有毒性作用,因此,整個體系中AOB和NOB作用均較弱,而NOB比AOB更敏感,會導致NOB的占比更低。在階段Ⅲ中,停止加入N2H4后,R2和R3中AOB和AnAOB的占比逐漸上升,體系中的脫氮效果也在緩慢提升,可見N2H4的抑制效果是可逆的,但N2H4為5mg·L-1的R2能逐漸恢復到抑制前的脫氮水平,而投加10mg·L-1 N2H4的R3較難恢復。
2.4 N2H4對EPS的影響
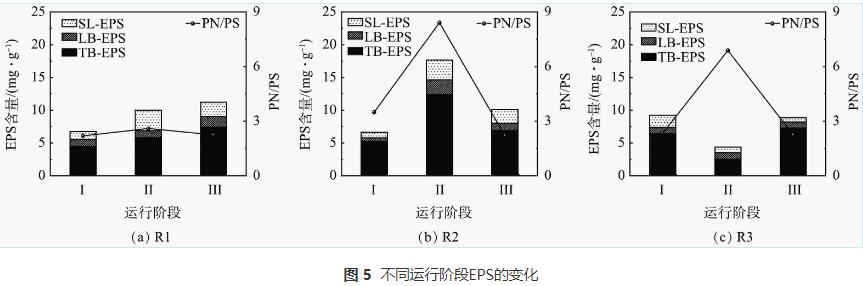
EPS對生物膜的形成和穩定有重要作用,因此,有必要探討N2H4對生物膜EPS的影響。3個反應器中EPS變化量及蛋白質和多糖的比值(PN/PS)變化情況如圖5所示。對照組R1的EPS處于穩定增長狀態,各階段EPS含量分別為6.76、10.03和11.22mg·g-1,PN/PS穩定在2.19~2.59,與反應器中NRR的變化趨勢一致。階段Ⅱ結束時(第46天),R2中EPS由階段I的6.60mg·g-1增加到17.68mg·g-1,同時PN和PS的含量也發生變化,PN/PS由3.49增加到8.23。由于外部環境的改變會刺激細菌分泌較多的EPS,這種自我保護行為會適當減輕不良環境造成的影響,N2H4的毒性作用導致R2內的細菌分泌大量EPS。EPS中的PN/PS通常用于定義生物膜的狀態,活性污泥的PN/PS維持在1~4是一個適宜的水平。由于PN會比PS優先響應外部環境變化,且較高質量濃度N2H4可通過分泌大量結合蛋白(boundprotein,B-PN)觸發厭氧氨氧化污泥的自我保護機制,導致R2中的PN增長了2倍,生物膜變得蓬松不穩定,促進了生物膜的脫落和流失,引起反應器運行效能的下降。這與階段Ⅱ觀察到的反應器出水濁度增大以及NRR的下降一致。與R2相反,R3內的EPS由9.23mg·g-1下降到4.38mg·g-1,PN/PS的值由2.33增加到6.88。這可能是由于R3中N2H4質量濃度過高,對生物膜產生更強的毒性致使微生物死亡,導致EPS含量下降。停止加入N2H4后,R2的EPS含量下降了42%,PN/PS為2.20,與對照組R1近乎相平。R3的EPS含量逐漸升高至8.84mg·g-1,PN/PS為2.25。PN/PS的值越低則系統穩定性越高,2個反應器內PN/PS均降到適宜范圍(1~4)內,可證明污泥結構已經趨于穩定,受N2H4刺激后生物膜緩慢恢復。
2.5 N2H4對血紅素的影響
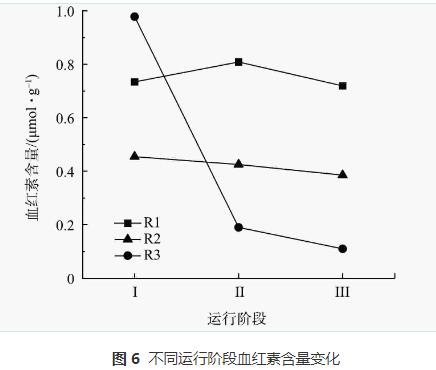
血紅素參與AnAOB的主要代謝反應,具有催化和電子轉移潛力,可以作為評估厭氧氨氧化性能的指標。不同質量濃度N2H4對AnAOB中血紅素的影響如圖6所示。對照組R1各階段的血紅素含量分別為0.73、0.81、0.72μmol·g-1,整體維持在平穩狀態。R2和R3中血紅素含量均呈現下降的趨勢。R2從0.45μmol·g-1 降至0.39μmol·g-1,R3則從0.78μmol·g-1降至0.11μmol·g-1。在厭氧氨氧化的代謝過程中,N2H4作為厭氧氨氧化過程的中間產物,會被脫氫酶(hydrazinedehydrogenase,HDH)氧化成N2,從而完成脫氮過程。細胞色素c的含量與HDH活性存在正相關,HDH酶的活性越高,處于還原狀態的細胞色素c的就越多,而血紅素是細胞色素c的關鍵組分。在本研究中,加入N2H4后的生物膜中的血紅素含量一直下降,即HDH的活性一直下降,阻礙了厭氧氨氧化過程中催化N2H4氧化生成N2這一反應的正向進行,從而導致N2H4積累。由于N2H4具有強毒性,HDH受到高質量濃度N2H4的抑制,血紅素的還原能力下降,AnAOB的活性受抑制,最終導致系統中NRR下降。此外,通過對比R2和R3在整個反應階段血紅素的變化量,可看出N2H4的加入量越高,抑制作用越明顯,厭氧氨氧化活性越難以恢復。
2.6 N2H4對微生物群落的影響
反應器在不同運行周期門水平和屬水平的微生物群落結構如圖7所示。可以看出,細菌的相對豐度隨運行條件的改變有明顯差異,表明N2H4對微生物群落的影響逐漸顯現。由圖7(a)中可觀察到所有樣本中的主要優勢菌門有變形菌門(Proteobacteria)、浮霉菌門(Planctomycetes)、擬桿菌門(Bacteroidetes)、綠彎菌門(Chloroflexi)和裝甲菌門(Armatimonadetes),這些都是脫氮系統中常見的典型細菌。有研究表明AnAOB隸屬于浮霉菌門,對照組R1在整個運行周期內Planctomycetes一直維持在較高水平(12.86%~23.36%),實現了MBBR脫氮系統的長期穩定運行。加入N2H4后,R2中Planctomycetes呈現先上升至26.33%,而后下降至2.50%的現象,豐度的上升與NRR的短暫增加的結果相一致。R3內幾乎不存在Planctomycetes,其相對豐度從4.44%下降到2.86%,同時可觀察到放線菌門(Actinobacteria)和酸桿菌門(Acidobacteria)占明顯優勢,其相對豐度分別由0.55%和0.31%增長至7.17%和10.46%,說明N2H4會促進其它菌門的生長,Planctomycetes與Actinobacteria等菌門之間對底物的競爭增大,降低了AnAOB的占比,破壞脫氮系統的穩定性。
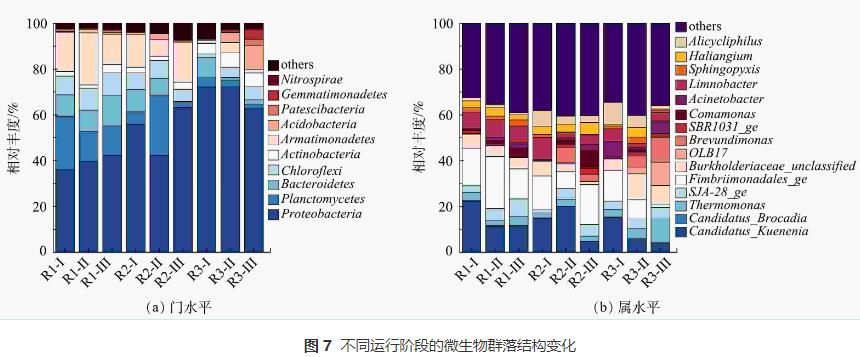
圖7(b)反映了了各反應器在不同運行階段,相對豐度占比在前15的主要菌屬。樣品中均檢測出2種屬水平AnAOB,Candidatus_Kuenenia和Candidatus_Brocadia,其中以Candidatus_Kuenenia為主。對照組R1在整個運行周期內Candidatus_Kuenenia一直維持在較高水平(11.18%~22.37%),即使在階段Ⅱ略有下降但仍占主導地位。對比階段Ⅲ和階段Ⅰ,R2和R3中Candidatus_Kuenenia所占比例分別下降了64%和61%,表明長期添加微量N2H4會使AnAOB相對豐度降低,這與反應器運行過程中系統脫氮效率降低的現象一致。Fimbriimonadales在對照組R1中的相對豐度較高,為13.18%~22.68%。有研究表明,Fimbriimonadales是一種異養菌,也可以利用NH4+-N和NO2--N生成N2。本研究中Fimbriimonadales可能與AnAOB共存于反應器中協同脫氮。對照組R1中Burkholderiaceae一直維持在4.89%~6.37%,R3中Burkholderiaceae的相對豐度從階段Ⅰ的5.16%上升到階段Ⅱ的11.17%。Burkholderiaceae屬于反硝化細菌,具有還原NO3--N或NO2--N的能力。可見,N2H4的長期加入促進了Burkholderiaceae的生長,加大了對底物NO2--N的競爭,抑制了AnAOB生長。有研究表明,Limnobacter可與AnAOB共生,這可以保護AnAOB免受不利環境的影響。對照組中Limnobacter的豐度穩定在7%左右,但該菌屬在R2中的豐度由9.55%降至2.12%,R3中由5.64%降至1.62%。N2H4會破環這種保護平衡,令AnAOB暴露在不利環境中,從而降低其活性。終上所述,N2H4不僅直接降低Candidatus_Kuenenia的豐度,還對與AnAOB菌屬協同脫氮的其它菌屬起到抑制作用,從而降低反應器整體功能菌屬的活性,進而影響脫氮效果。
3、結論
1)在進水NH4+-N質量濃度在(50.9±3.6)mg·L-1,NO2--N質量濃度在(55.5±3.2)mg·L-1的條件下,加入5mg·L-1和10mg·L-1的N2H4可以使NRR短暫增長,但長期運行后NRR分別下降了53%和64%。N2H4的長期加入會對生物膜產生生物毒性,抑制脫氮過程。
2)5mg·L-1的N2H4使生物膜的EPS分泌量提高,觸發生物膜保護機制,解除N2H4抑制后,EPS濃度恢復,但生物膜變得松散,易脫落,導致污泥流失。10mg·L-1的N2H4抑制了生物膜中AnAOB的活性,EPS和血紅素含量均明顯下降,解除N2H4抑制后,生物膜脫氮活性也難以恢復。
3)長期添加微量N2H4會降低厭氧氨氧化生物膜脫氮系統中Planctomycetes和Candidatus_Kuenenia的豐度。(來源:北京工商大學生態環境學院,唐山曹妃甸城市排水有限公司,浦華控股有限公司)



