城鎮污水處理廠生化尾水深度凈化脫氮常采用異養反硝化工藝,安全廉價的碳源是該工藝高效運行的關鍵。與常用液態碳源相比,可生物降解型人工合成聚合物固體碳源因運輸安全、釋碳穩定而成為反硝化脫氮領域的研究熱點。聚乳酸(PolylacticacidPLA)、3-羥基丁酸/戊酸酯共聚物(Polyhydroxy-butyrate-co-valeratePHBV)、聚己內酯(Poly(ε-caprolactone)PCL)和聚丁二酸丁二醇酯(Poly(ButyleneSuccinate)PBS)等聚合物具有良好釋碳性能。但PHBV,PCL和PBS等聚合物在合成過程中存在聚合條件苛刻、催化劑毒性高等問題,存在安全隱患。PLA能夠由乳酸直接縮聚而成,合成方法簡單、價格低廉,被認為是最具有發展潛力的可生物降解聚合物。
目前,關于PLA作為固體碳源進行反硝化脫氮的研究多以工程應用為主。FAN等研究了PLA反硝化脫氮的污泥培養時間(35d)與適宜溫度(30~40℃)。彭書林等優化了PLA反硝化系統的適宜進水pH范圍為7.8~10.1。TAKAHASHI等從PLA水解產物角度判斷了不同分子量PLA的脫氮效果,指出低分子量PLA脫氮效果更好。但是不同分子量PLA的脫氮路徑及相應機制尚不清晰,這是異養微生物脫氮過程高效調控的理論基礎。
本研究選取分子量為5000g·mol−1,10000g·mol−1和50000g·mol−1的PLA,在探究其釋碳性能和反硝化效果的基礎上,通過分析出水溶解性有機質(DOM)組分及微生物群落結構,揭示不同分子量PLA反硝化脫氮路徑與機制,以期為PLA應用于低碳脫氮提供參考。
1、材料與方法
1.1 實驗原料
本實驗選用直接聚合法合成的PLA。該方法流程簡單成本較低,合成的PLA分子量在5000~50000g·mol−1 。因此,本實驗選取分子量為5000g·mol−1,10000g·mol−1,50000g·mol−1的PLA進行研究。PLA的形態為白色橢球形顆粒,其直徑為2~3mm、長為3~4mm。其他試劑均采用分析純。模擬廢水的制備方法:在自來水中加入NaNO3和KH2PO4,使NO3−-N質量濃度為30mg·L−1,PO43−-P質量濃度為6mg·L−1;微量元素溶液按1mL·L−1體積分數添加,其組分如表1所示。
1.2 實驗方法
1)聚乳酸PLA靜態釋碳研究方法。取3只500mL錐形瓶,分別加入300mL去離子水,并加入100g分子量為5000g·mol−1、10000g·mol−1、50000g·mol−1的PLA,瓶口密封,放置于35℃、80r·min−1恒溫培養箱中。每24h取樣并更換去離子水,連續更換17d。之后,測定水樣COD,并計算PLA的累計釋碳率(cumulativecarbonreleaserate)。
2)聚乳酸PLA反硝化研究方法。取3只500mL錐形瓶,加入300mL模擬廢水和150mL活性污泥(MLSS為3g·L−1),分別加入100g分子量為5000g·mol−1、10000g·mol−1、50000g·mol−1的PLA,瓶口密封,放置于35℃、80r·min−1恒溫培養箱中。每24h取樣并更換300mL模擬廢水,連續更換36d,并于第1天、第17天和第37天取樣分析DOM組分,于第37天取樣分析微生物群落結構。測定水樣NO3−-N、NO2−-N、NH4+-N、COD,并計算反硝化速率(Denitrificationrate)。
3)PLA累計釋碳率計算。PLA累計釋碳率可用CR來表示,計算如式(1)所示。
![]()
式中:CRd為第d天的累計釋碳率;Ci為第i天的COD,mg·L−1;V為實驗溶液體積,L;TC為釋碳實驗所使用PLA總含碳量,mg。
4)PLA反硝化速率計算。反硝化速率可以用DR表示,如式(2)所示。
![]()
式中:DR為反硝化速率,mg·L−1·h−1;C0和Ce分別為NO3−-N初始濃度和出水質量濃度,mg·L−1。本研究中水力停留時間(HRT)統一為24h。
1.3 分析測試方法
水樣經0.45μm膜濾膜過濾后測定相關參數。其中,NO3−-N采用紫外分光光度法測定;NO2−-N采用N-(1-萘基)-乙二胺光度法測定;NH4+-N采用納氏試劑法測定;COD采用快速消解分光光度法(DR-1900,哈希,美國)測定。三維熒光光譜采用日立(Hitachi)F-7000熒光分光度計測定,激發波長(λex)掃描范圍:200~450nm,發射波長(λem)掃描范圍:250~600nm;狹縫寬帶:λex=5nm,λem=5nm;掃描速度2400nm·min−1。三維熒光光譜(3D-EEM)根據激發波長和發射波長的不同范圍分為5個區域。這5個區域分別為Ⅰ區(λex/λem=(200~250nm)/(250~330nm),類酪氨酸物質)、Ⅱ區(λex/λem=(200~250nm)/(330~380nm),類色氨酸物質)、Ⅲ區(λex/λem=(200~250nm)/(380~550nm),類富里酸物質)、Ⅳ區(λex/λem=(250~400nm)/(250~380nm),溶解性微生物代謝產物物質)、Ⅴ區(λex/λem=(250~400nm)/(380~550nm),類腐殖酸物質)。按照熒光區域積分(FRI)分析法,通過Origin9.1計算熒光區域的積分體積Фi;對熒光區域的積分體積進行標準化,得到區域i的標準化積分體積Фi,n;再計算總熒光區域標準化積分體積ФT,n;最后計算區域i標準化積分體積占總標準化積分體積之比Pi,n。
微生物群落結構采用16SrRNA高通量測序進行分析。污泥樣品采集后置于10mL離心管內,-20℃保存,隨后進行樣品DNA提取,采用通用引物338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)對樣品16SrRNA基因V3-V4可變區進行PCR擴增。PCR產物用QuantiFluor™-ST定量系統(美國Promega公司)檢測定量后,最后利用IlluminaMiseqPE300平臺進行測序。使用Uparse軟件(version11),根據97%的相似度對序列進行OTU聚類。利用RDPclassifier(version2.13)對每條序列進行物種分類注釋,比對Silva16SrRNA數據庫(version138),設置比對閾值為70%,并在門、科和屬水平上統計不同樣本的群落組成。
2、結果與討論
2.1 PLA靜態釋碳性能
分子量為5000g·mol−1、10000g·mol−1和50000g·mol−1的PLA靜態釋碳性能如圖1所示。PLA的分子量增大,其釋碳穩定性越好。分子量為5000g·mol−1、10000g·mol−1的PLA釋碳表現出明顯的兩階段性:第1天為快速釋碳階段,COD分別降為40mg·L−1和33mg·L−1;第2~17天為緩慢釋碳階段,每天穩定釋放COD約20mg·L−1。分子量50000g·mol−1的PLA未見明顯的階段性,而周期內COD釋放量每天保持約20mg·L−1。不同分子量PLA在17d內累計釋放率穩定增長,且不超過0.1%。

性能良好的固體碳源在清水中釋碳能力較弱,可在微生物作用下釋放反硝化脫氮所需碳源。上述數據表明,不同分子量的PLA均可長時間進行低量釋放碳源,為一種性能良好的固體碳源。這歸因于PLA的水溶性差,在清水中可長時間低量釋碳(約為20mg·L−1),與PCL、PHBV等人工合成碳源釋碳量相近(13.35~26.70mg·L−1),遠低于玉米芯和花生殼等天然碳源(200~300mg·L−1);而固體碳源靜態釋碳過高,應用脫氮系統中會造成出水有機物含量超標。
2.2 PLA反硝化脫氮性能
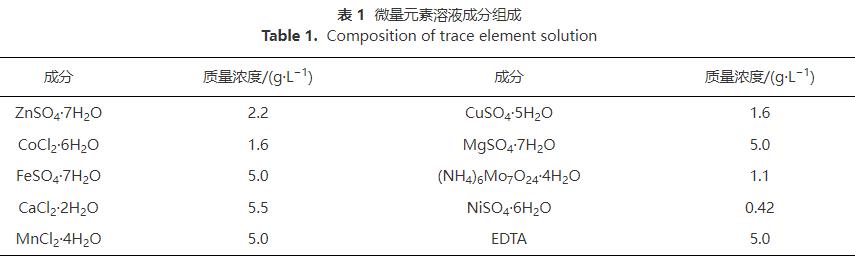
當PLA分子量分別為5000g·mol−1、10000g·mol−1和50000g·mol−1時,出水NO3−-N質量濃度變化、去除率和反硝化速率如圖2所示,副產物NH4+-N質量濃度和不同形態N比例變化如圖3。
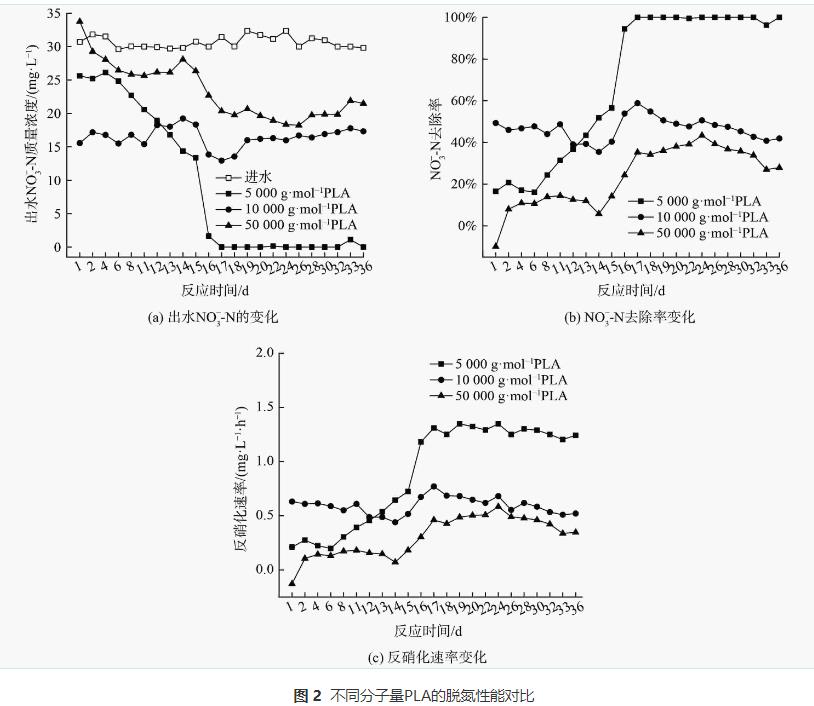
隨著PLA分子量的增加,出水NO3−-N質量濃度增大,去除率和反硝化速率降低。第1~16天,不同分子量PLA的出水NO3−-N質量濃度均隨時間逐漸下降,去除率和反硝化速率逐漸升高;第17~36天,不同分子量PLA出水NO3−-N質量濃度、去除率和反硝化速率均呈穩定趨勢,5000g·mol−1分子量PLA的NO3−-N去除率和反硝化速率可分別達到100%和1.29mg·L−1·h−1。分析其原因,在反硝化過程中,微生物無法直接利用PLA顆粒,而是以PLA的水解產物作為碳源。PLA會在微生物分泌的胞外水解酶作用下,發生內部酯鍵水解而形成小分子有機酸 ,胞外水解酶會優先催化水解PLA的非晶區。PLA水解出小分子有機物的能力也與其分子量密切相關。低分子量PLA主要以非晶區存在更容易被胞外酶催化水解提供有效碳源,故其反硝化效果更好。
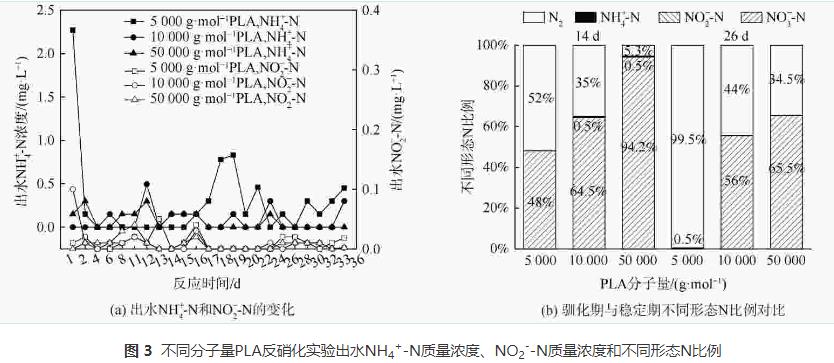
由圖3 (a)可知,在反應過程中,PLA分子量分別為10000g·mol−1、50000g·mol−1時,NH4+-N無明顯積累(<0.5mg·L−1)。PLA分子量為5000g·mol−1時,反應1d時出水NH4+-N質量濃度為2.27mg·L−1。這可能是由于PLA分子量為5000g·mol−1時,反應器的接種污泥釋放了在污水處理廠吸附的銨;而在后續實驗階段,NH4+-N稍有積累,最高質量濃度為0.83mg·L−1,這可能是由于反應器內發生了硝酸鹽異化還原為銨(dissimilatorynitratereductiontoammonium,DNRA)的反應。PLA分子量為5000g·mol−1時,NH4+-N積累量大于PLA分子量為10000g·mol−1和50000g·mol−1時。這是因為PLA分子量為5000g·mol−1時,能釋放更多碳源并加強DNRA作用。DNRA作用常見于固體碳源脫氮過程,但NH4+-N積累量會隨不同種類碳源變化。一般情況下,天然固體碳源的效果會優于聚合物類固體碳源。而本實驗結果表明,PLA為固體碳源時,其出水NH4+-N積累量(<0.83mg·L−1)會低于PHBV(1.14mg·L−1)等其他聚合物碳源。不同分子量PLA反硝化實驗出水NO2−-N無明顯積累(<0.2mg·L−1)。異養反硝化反應以有機物為電子供體,分為NO3−-N被還原為NO2−-N與NO2−-N被還原為N2兩步,分別由硝酸鹽還原酶和亞硝酸鹽還原酶催化進行。出水NO2−-N無明顯積累表明以PLA為固體碳源的反硝化反應的限速步驟為NO3−-N被還原為NO2−-N過程,而NO2−-N能迅速被亞硝酸鹽還原酶還原為N2。
由圖3 (b)可知,穩定期(第17~36天)不同分子量PLA反硝化氮氣轉化率均高于馴化期(第1~16天),5000g·mol−1分子量PLA穩定期氮氣轉化率達到99%,且不同分子量PLA反硝化出水NO2−-N無明顯積累。這表明5000g·mol−1分子量的PLA能實現完全反硝化,幾乎不生成NO2−-N和NH4+-N等副產物。
2.3 PLA反硝化脫氮機制
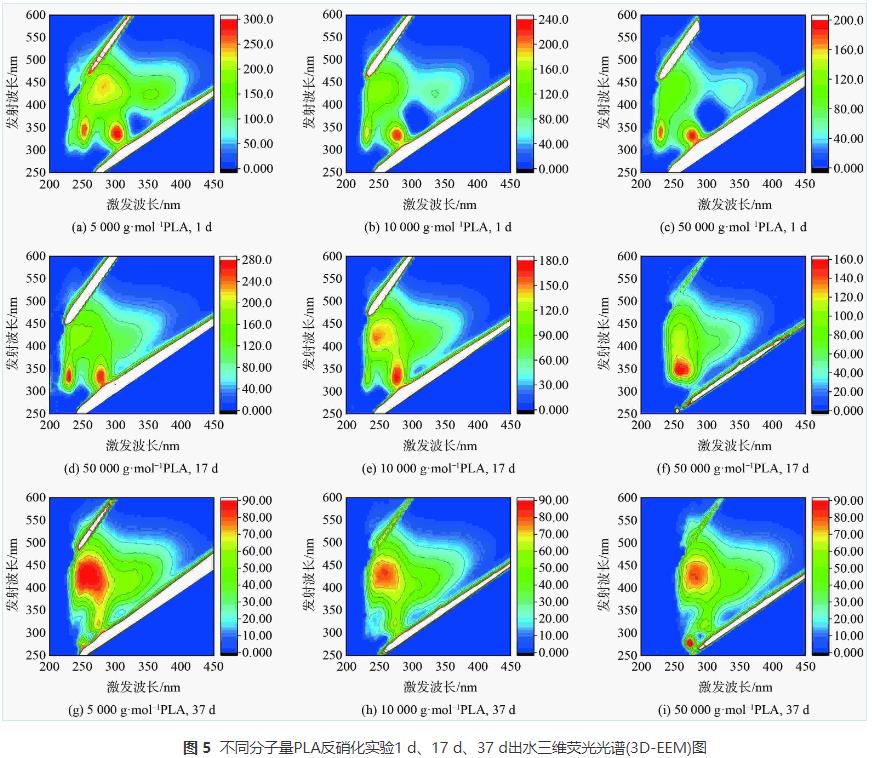
1)PLA反硝化電子供體有機質來源。分子量分別為5000g·mol−1、10000g·mol−1和50000g·mol−1的PLA對應反硝化出水COD的變化如圖4所示,溶解性有機質(DOM)組分變化如圖5、6和7所示。
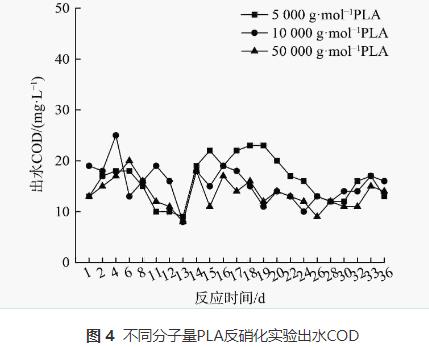
由圖4可知,分子量為5000g·mol−1、10000g·mol−1和50000g·mol−1的PLA對應的反硝化實驗出水COD較穩定,平均COD分別為16.26mg·L−1、15.35mg·L−1和14.17mg·L−1。固體碳源反硝化系統內COD主要取決于微生物作用下碳源釋放過程與異養反硝化等碳源利用過程。圖4中出水COD穩定表明脫氮系統內碳源的釋放與利用達到平衡,即在脫氮過程中微生物水解PLA釋放的碳源會被微生物菌群迅速用于反硝化脫氮及自身生長繁殖。
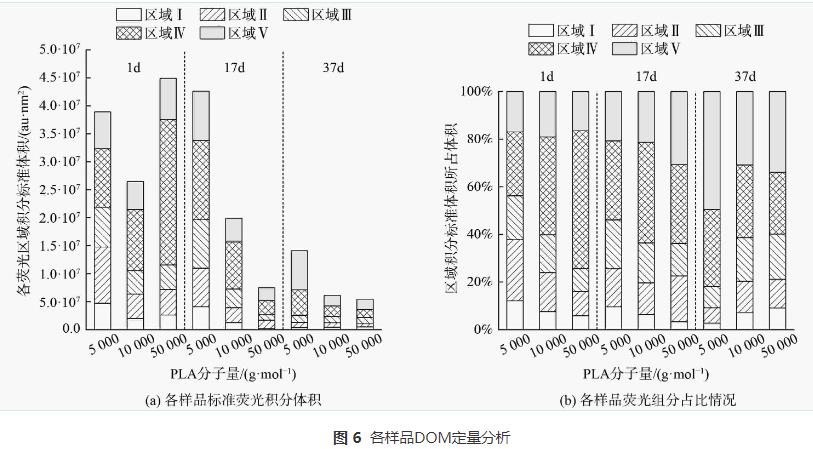
根據三維熒光光譜(3D-EEM)的特定波長熒光強度數據,能顯示水中溶解性有機質(DOM)的組分特征。由三維熒光光譜(圖5)可知,不同分子量PLA反硝化出水中DOM組分主要為溶解性微生物代謝產物、腐殖酸類、富里酸類及少量蛋白質類物質。為進一步探究DOM的熒光特性,運用熒光光譜FRI對DOM的三維熒光光譜進行定量分析。各樣品的總積分標準體積見圖6 (a)。隨著實驗的進行,反應器中DOM的熒光強度逐漸降低。這說明PLA異養反硝化能去除水中DOM。各熒光組分占比見圖6 (b)。隨著反硝化時間的延長,反應器內溶解性微生物代謝產物和類蛋白質物質組分占比降低,而腐殖酸類和富里酸類物質組分占比升高。這是因為溶解性微生物代謝產物等易降解有機物在反硝化過程中會逐漸轉化為腐殖酸類和富里酸類等難降解有機物,A2O工藝的缺氧池中也存在以微生物代謝產物為電子供體的反硝化過程,同時產生腐殖酸。因此,PLA反硝化脫氮電子供體來源不僅有PLA釋放的小分子碳源,還有溶解性微生物代謝產物等有機物。
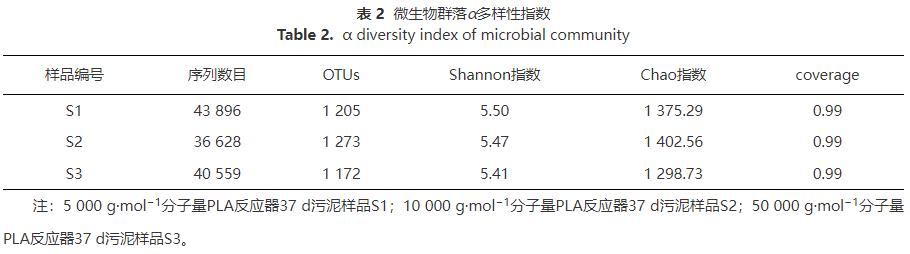
2)PLA脫氮微生物學機制分析。分子量分別為5000g·mol−1、10000g·mol−1和50000g·mol−1的PLA對應的反硝化脫氮系統微生物群落多樣性分析結果:α多樣性指數如表2所示,微生物門、科和屬水平群落結構如圖7和8所示。
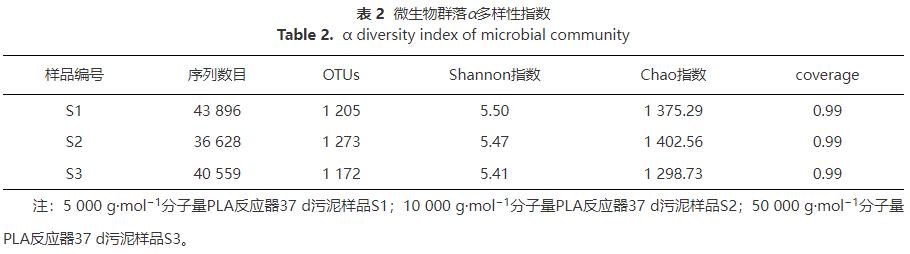
表2表明,所有樣品覆蓋率(coverage)均為0.99,代表測序結果真實可靠。反應器中Shannon和Chao指數基本無變化并保持在較高數值,證明PLA分子量對微生物群落豐富度和多樣性影響不大,且PLA反應器內微生物活性較高,同時也表明PLA可作為反硝化固體碳源。
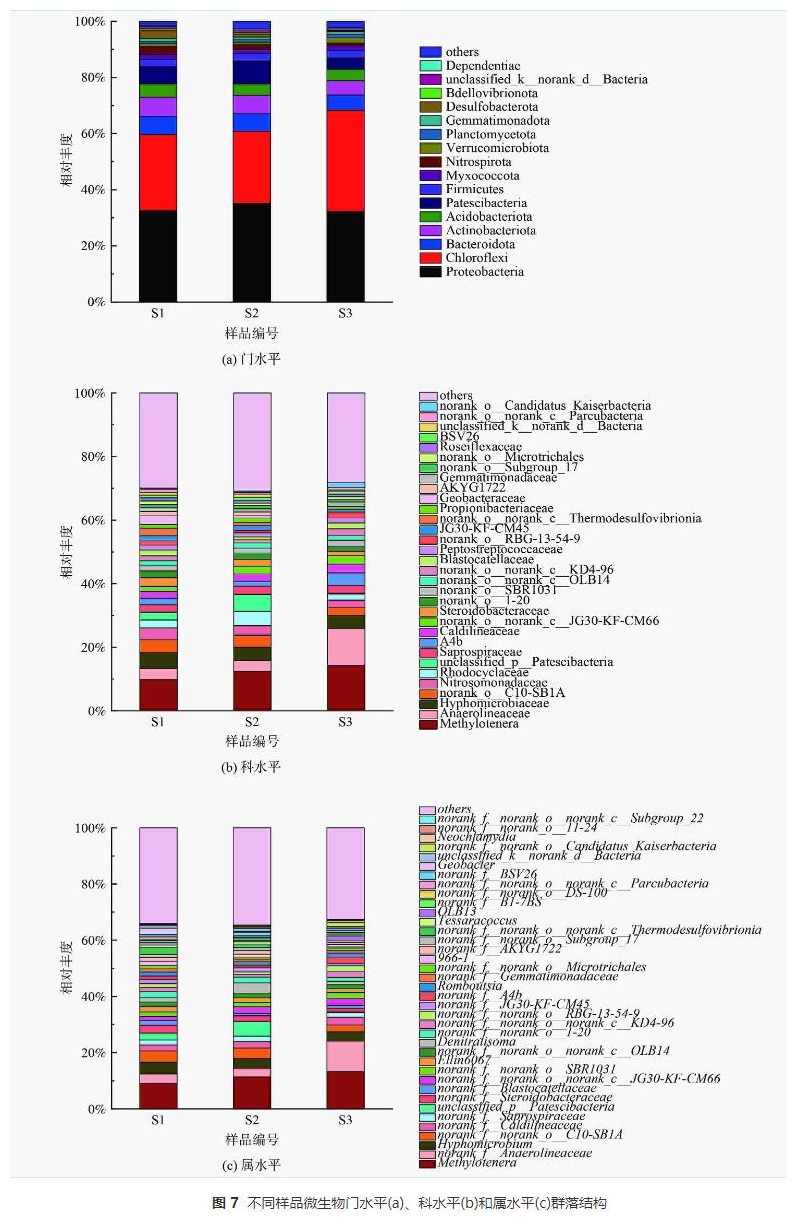
不同污泥樣品在門水平上的分布如圖7 (a)所示,主要優勢門主要有變形菌門(Proteobacteria)(32.28%~35.12%)、綠彎菌門(Chloroflexi)(25.67%~36.00%)、放線菌門(Actinobacteriota)(5.11%~6.82%)、CPR細菌(Patescibacteria)(3.92%~8.14%)和擬桿菌門(Bacteroidota)(5.47%~6.27%)。常見的還原硝酸鹽的反硝化菌屬大多在變形菌門(Proteobacteria)和擬桿菌門(Bacteroidota)下,不同分子量PLA反應器內變形菌門(Proteobacteria)與擬桿菌門(Bacteroidota)相對豐度之和為37.75%~41.38%。這表明各反應器內這2種菌門為優勢菌門。綠彎菌門(Chloroflexi)下的微生物能在厭氧條件下吸收來自細胞裂解的肽聚糖等物質,其部分屬能利用細胞釋放的微生物代謝產物作為電子供體進行反硝化作用,S3樣品內綠彎菌門(Chloroflexi)相對豐度(36.00%)明顯高于S1(27.97%)、S2(25.67%)樣品。推測這是由于分子量50000g·mol−1的PLA無法釋放出足夠碳源以供微生物生長所需,使得微生物細胞裂解釋放肽聚糖,造成綠彎菌門(Chloroflexi)等菌群相對豐度的增加。放線菌門(Actinobacteriota)與CPR細菌(Patescibacteria)常見于城市污水處理廠活性污泥內。
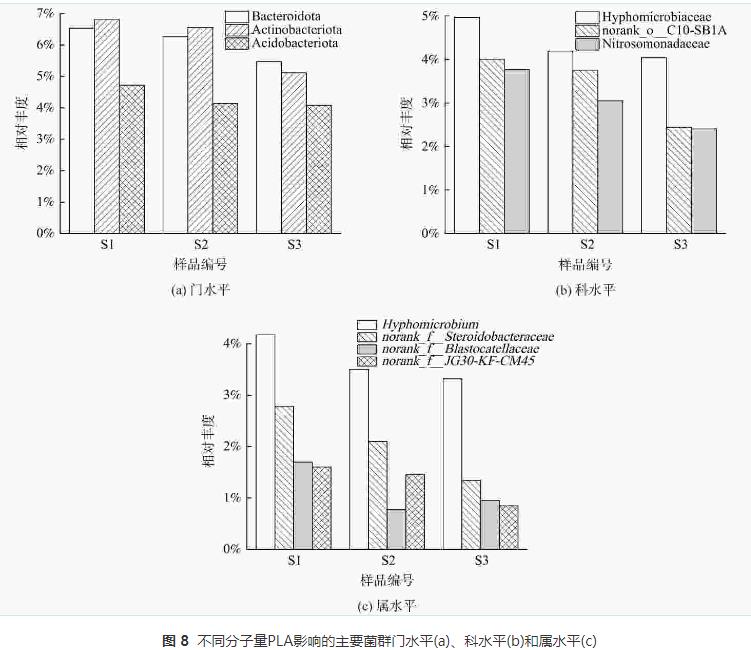
由圖8 (a)可知,S1樣品擬桿菌門(Bacteroidota)、放線菌門(Actinobacteriota)和酸桿菌門(Acidobacteriota)相對豐度均高于S2和S3樣品。擬桿菌門(Bacteroidota)下的微生物可以降解紙漿等有機物從而釋放碳源,放線菌門(Actinobacteriota)下的微生物能合成胞外水解酶降解大分子有機物,其部分屬能夠水解PLA。隨著PLA分子量的升高,擬桿菌門(Bacteroidota)和放線菌門(Actinobacteriota)豐度降低。這表明5000g·mol−1分子量PLA更容易富集PLA水解相關菌門,從而釋放更多碳源。酸桿菌門(Acidobacteriota)中的微生物帶有narG、nirK和nirS等多種反硝化功能基因能夠編碼合成硝酸鹽還原酶和亞硝酸鹽還原酶,并能在厭氧條件下利用乙酸等有機物還原硝酸鹽。
樣品在科水平上的分布如圖7 (b)所示,樣品中共檢測出32個科。前十個主要優勢科是:嗜甲基菌科(Methylophilaceae)(9.82%~14.32%)、厭氧繩菌科(Anaerolineaceae)(3.44%~11.62%)、生絲微菌科(Hyphomicrobiaceae)(4.04%~4.97%)、norank_o_C10-SB1A(2.44%~3.76%)、亞硝化單胞菌科(Nitrosomonadaceae)(2.40%~3.77%)、紅環菌科(Rhodocyclaceae)(1.96%~4.53%)、unclassified_p_Patescibacteria(0.18%~5.25%)、腐敗螺旋菌科(Saprospiraceae)(2.37%~2.63%)、A4b(1.56%~3.94%)、暖繩菌科(Caldilineaceae)(2.18%~2.80%)。嗜甲基菌科(Methylophilaceae)、厭氧繩菌科(Anaerolineaceae)、生絲微菌科(Hyphomicrobiaceae)、紅環菌科(Rhodocyclaceae)和暖繩菌科(Caldilineaceae)均為硝酸鹽還原菌;亞硝化單胞菌科(Nitrosomonadaceae)是一種氨氧化菌(ammoniaoxidizingbacterium,AOB),能氧化氨氮為亞硝酸鹽;腐敗螺旋菌科(Saprospiraceae)是一種亞硝酸鹽還原菌。上述各菌科均為反硝化脫氮過程的關鍵功能科,廣泛存在于全球各地廢水脫氮反應器中。norank_o_C10-SB1A為硝酸鹽異化還原為氨(DNRA)功能菌群。A4b曾在含有PLA的反硝化系統中檢測出,是一種能降解大分子有機物的微生物。
如圖8 (b)所示,S1樣品生絲微菌科(Hyphomicrobiaceae)、norank_o_C10-SB1A和亞硝化單胞菌科(Nitrosomonadaceae)相對豐度高于S2和S3樣品。這表明含有5000g·mol−1分子量PLA的反應器中起主要反硝化作用的菌科為生絲微菌科(Hyphomicrobiaceae),且該菌生物活性較高,能在相對豐度小于5%的情況下,完成反硝化脫氮。norank_o_C10-SB1A和亞硝化單胞菌科(Nitrosomonadaceae)豐度較高,可能是因為5000g·mol−1分子量PLA能夠釋放較多碳源以致DNRA菌群(norank_o_C10-SB1A)繁殖,使得短時間內NH4+-N得到積累,促進了以NH4+-N為基質的亞硝化單胞菌科(Nitrosomonadaceae)的生長。因此,盡管norank_o_C10-SB1A相對豐度較高,出水NH4+-N卻未見明顯積累。
樣品在屬水平上的分布如圖7 (c)所示,共檢測出38個屬。前十個主要優勢屬為:甲基嬌養桿菌屬(Methylotenera)(9.09%~13.26%)、norank_f_Anaerolineaceae (3.03%~10.85%)、生絲微菌屬(Hyphomicrobium)(3.50%~4.17%)、norank_f_norank_o_C10-SB1A (2.44%~4.00%)、norank_f_Caldilineaceae (2.10%~2.74%)、norank_f_Saprospiraceae (1.65%~1.91%)、unclassified_p_Patescibacteria (0.18%~5.25%)、norank_f_Steroidobacteraceae (1.34%~2.78%)、norank_f_Blastocatellaceae (0.18%~1.70%)、norank_f_norank_o_norank_c_JG30-KF-CM66 (1.49%~2.62%)。其中,甲基嬌養桿菌屬(Methylotenera)和生絲微菌屬(Hyphomicrobium)是典型反硝化菌屬具有還原硝酸鹽的作用,常見于反硝化活性污泥。norank_f_Anaerolineaceae、norank_f_Blastocatellaceae、norank_f_norank_o_norank_c_JG30-KF-CM66和norank_f_Steroidobacteraceae屬均與復雜有機物代謝有關。norank_f_Caldilineaceae和norank_f_Saprospiraceae屬是通過消耗有機物進行反硝化作用的功能細菌。norank_f_norank_o_C10-SB1A為norank_o_C10-SB1A科下的細菌為DNRA作用的關鍵功能屬。
如圖8 (c)所示,S1樣品中生絲微菌屬(Hyphomicrobium)、norank_f_Steroidobacteraceae、norank_f_Blastocatellaceae和norank_f_JG30-KF-CM45屬相對豐度高于S2和S3樣品。生絲微菌屬(Hyphomicrobium)是隸屬于生絲微菌科(Hyphomicrobiaceae)的微生物,是反硝化作用的關鍵細菌。 norank_f_JG30-KF-CM45屬也是反硝化功能屬,豐度與有機物濃度成正比。norank_f_Blastocatellaceae屬參與代謝有機高分子物質,可能與聚合物水解過程有關。norank_f_Steroidobacteraceae屬參與木質素生物降解和解聚過程,也可水解有機聚合物。屬水平結果表明5000g·mol−1分子量PLA能富集更多水解功能菌群。
總體來說,不同分子量PLA脫氮系統內微生物在門、科和屬水平上的分布不同。5000g·mol−1分子量的PLA更有利于富集水解功能菌群。PLA反硝化生物脫氮路徑主要有兩條:反硝化功能菌群利用水解大分子有機物的微生物分解PLA釋放的小分子碳源作為電子供體進行異養反硝化作用;微生物利用溶解性微生物代謝產物等有機物進行反硝化脫氮。
3、結論
1)PLA作為固體碳源,在清水中能夠長期穩定釋放碳源,反硝化脫氮過程中釋碳主要依靠生物作用。PLA反硝化脫氮效果表明,PLA分子量越低,脫氮效率越高。不同分子量PLA出水NO2−-N和NH4+-N等副產物均未見明顯積累。5000g·mol−1分子量的PLA作為反硝化固體碳源更具有優勢。
2)DOM組分和微生物測序結果表明,5000g·mol−1分子量的PLA更有利于富集水解相關功能菌群。PLA脫氮路徑有兩條:一是反硝化功能菌群利用水解微生物分解PLA釋放的小分子碳源作為電子供體進行異養反硝化作用;一是微生物利用溶解性微生物代謝產物等有機物進行反硝化脫氮。(來源:中國環境科學研究院水生態環境研究所,蘭州交通大學環境與市政工程學院,西北師范大學化學化工學院,甘肅省膜科學技術研究院有限公司,生態環境部環境發展中心)



