1 引言
污水厭氧生化處理過程是指在無分子氧參與的條件下,有機物通過厭氧污泥中多種微生物的生化作用,分解為有機酸、CH4、CO2、H2等產物的過程.由于其具有處理負荷高、剩余污泥少、可產生沼氣等特征,因而在有機固體廢物(剩余污泥、廚余、農業廢棄物)減量、高濃度有機廢水、難降解廢水等處理中廣泛應用.影響厭氧處理過程的因子包括基礎因素(厭氧污泥組成、濃度、污泥負荷等)和環境因素(pH、ORP、抑制性物質等)兩大類,其中,厭氧污泥的生物相組成和代謝活性對厭氧生化處理的過程進展發揮著重要的作用.當采用不同的接種厭氧污泥時,由于微生物構成、對基質的適應性和接種量的不同,厭氧污泥產CH4活性存在較大差異.對厭氧污泥的產CH4活性進行系統地對比與研究,確定厭氧污泥產CH4生成勢,一方面可對厭氧污泥的厭氧凈化性能和產CH4活性進行評價,同時也能為厭氧工藝的關鍵操作參數優化提供依據.
末端限制性片段多態性(Terminal-Restriction fragment length polymorphism,T-RFLP)分析方法由RFLP發展而來,又稱為16S rRNA基因的末端限制性片段分析技術,是目前微生物分子生物學研究中有效的研究手段之一.該方法將PCR引物中的一條加以熒光標記,對擴增產物用限制性內切酶進行切割并電泳,根據片斷的大小不同及標記片斷種類和數量的不同來分析群落的結構及組成.Marsh等(1998)采用T-RFLP分析了活性污泥、生物反應器、沙質、地下水及白蟻消化道中的細菌組成,比較了這些群落結構的相似性,并將6種已知菌混和在一起組成模擬的群落進行了分析.Lüdemann等(2000)采用該技術分析了水稻種植區土壤中沿著氧垂直梯度上的細菌群落組成變化,同時結合16S rDNA克隆文庫的構建和測序分析,獲得了與氧垂直梯度相關的不同深度細菌群落組成情況.當前該技術已成功應用于微生物群落組成和結構及微生物系統發育等研究,在產CH4菌和CH4氧化菌的群落結構、動態變化的檢測中發揮著重要的作用.
本研究采用厭氧污泥生化產CH4生成勢(Biological methane potential,BMP)的測試方法,對AP、DH兩污水處理廠的厭氧污泥進行批次實驗,并對兩廠厭氧污泥的產氣速率與基質濃度進行回歸,得出產CH4的關鍵參數,評價不同厭氧污泥的產CH4生成勢.同時,對批次實驗前后的水質變化進行分析,結合厭氧污泥的T-RFLP與SEM分析結果,對兩種厭氧污泥產CH4生成勢的差異進行解析.
2 材料與方法
2.1 厭氧污泥來源與特征
本研究所用的兩種厭氧污泥分別來自于AP和DH兩污水處理廠的污泥厭氧消化池,AP污水處理廠采用合流制明渠排水溝進水,進水水質易受降雨影響,且泥沙等無機顆粒含量較高;DH污水處理廠配套管網設施完善,進水為完整的下水管網收集的城市生活污水.污水廠長期的監測數據表明,AP厭氧污泥的VSS/TSS值多在0.5以下,而DH厭氧污泥的VSS/TSS值維持在0.6以上.
2.2 BMP實驗設計
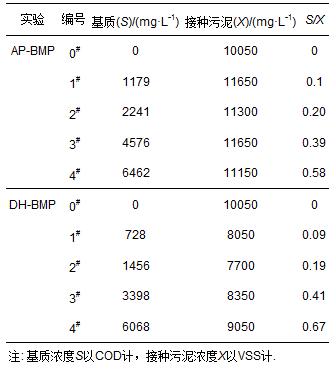
AP-BMP、DH-BMP共設置5組不同的食微比S/X(0、0.1、0.2、0.4、0.6)進行BMP實驗,實測S/X如表 1所示.依據測試基質濃度在120 mL的血清瓶中加入定量儲備NaAc溶液,基質體積為60 mL.厭氧微量元素溶液采用提出的配方,其中,CaCl2 · 2H2O、NH4Cl、MgCl2 · 6H2O、KCl、MnCl2 · 4H2O、CoCl2 · 6H2O、H3BO3、CuCl2 · 2H2O、Na2MoO4 · 2H2O、ZnCl2的濃度分別為16.7、26.6、120、86.7、1.33、2、0.38、0.18、0.17、0.14 g · L-1.每個血清瓶加入27 mL的微量元素液體和5.4 mL的(NH4)2HPO4(26.7 g · L-1),之后接種同量的厭氧污泥后,蓋上膠蓋并用鋁箔封口.在35 ℃下旋轉培養箱內進行實驗,實驗過程中以玻璃注射筒(50 mL)測量總產氣量,并利用GC-ECD測定CH4、CO2和H2的比例.AP-BMP、DH-BMP分別設置兩組平行實驗,產氣量測量可精確到0.1 mL.
表 1 BMP實驗實測S/X比
2.3 分析方法
2.3.1 常規指標
常規水質指標包括pH(Suntex Ion Analyzer 3000A)、SS(Sartorius Analytic Oven)、VSS(Sartorius Analytic Furnace)、NH3-N(Autotitrator AT-400KYOTO)、TKN(Autotitrator AT-400KYOTO)、COD(回流加熱滴定)等,均依照美國EPA規定的標準方法進行.實驗過程中氣體成分(CH4、CO2和H2)的測量采用氣相色譜(China Chromatography GC8900T)進行.厭氧污泥SEM鏡檢用Hitachi-2500 SEM進行.
2.3.2 T-RFLP分析
本文參照了Tillmann等(2000)建立的T-RFLP方法對實驗前后厭氧污泥的生物多樣性進行分析,步驟如下:①通過PCR來復制DNA樣品中的目標基因,引物為在5′的尾端上帶有熒光的Ar 109f和Ar 912r*,首先在94 ℃預變性5 min,擴增循環階段包括94 ℃變性1 min,52 ℃退火1 min,72 ℃延伸1.5 min,共循環28次,最后在72 ℃條件下延伸6 min;②在8.5 μL的PCR產物中加入0.5 μL Taq I和1.5 μL的緩沖溶液,在65 ℃條件下消化切割2 h;③將切割后的片段利用電泳分離并以熒光偵測器(全自動遺傳分析儀,ABI PRISM 3100 Genetic Analyzer)檢測片段上所帶的熒光強度.Tillmann等(2000)成功分離、克隆出產CH4髦毛菌Methanosaeta spp.、產CH4微菌Methanomicrobiaceae、RC-I和產CH4桿菌Methanobacteriaceae,未能定性的菌種歸入Diverse類.
2.3.3 數據分析
BMP實驗中的累積CH4產氣量采用改進的Gompertz模型回歸分析:
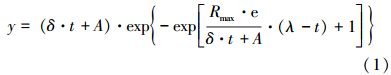
式中,y為累積產氣量(mL),δ為產氣末期校正斜率(mL · h-1),t為反應時間(h),A為平衡產氣量(mL),Rmax為最大產氣速率(mL · h-1),λ為遲滯期(h).
底物的厭氧代謝過程實質上是一系列的酶促反應,因此,采用Michaelis-Menten模型描述基質濃度與比產氣速率的關系:
式中,Vmax為最大比產氣速率(mL · g-1 · d-1,以VSS計),V為比產氣速率(mL · g-1 · d-1,以VSS計),Km為半飽和常數(mg · L-1,以COD計),S為基質濃度(mg · L-1,以COD計).
3 結果與討論
3.1 BMP產氣結果分析
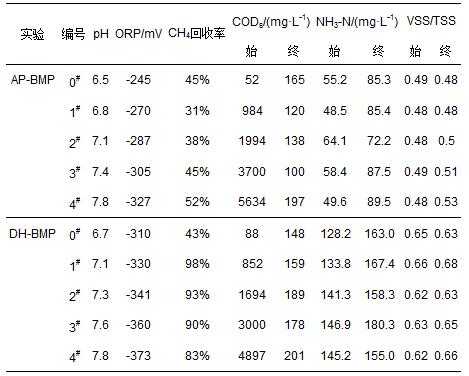
AP-BMP、DH-BMP批次實驗持續時間分別為239 h、286 h,由圖 1可知,5組不同投配比條件下的累積產氣量存在著明顯的差異.實驗初期,累積產氣量差異不明顯,后期逐步增大.氣體成分以CH4(80%)、CO2(20%)為主,同時存在少量的H2(不足1%).以NaAc為基質的實驗,由于不經歷酸化水解的限速階段,產氣速度較快,但高濃度的NaAc對厭氧污泥也存在著一定的抑制作用,例如,DH-BMP實驗中,S/X值最高的4#樣品產CH4量在170 h后才超過3#樣品.AP-BMP實驗中,4#樣品的產CH4量最高,達到了166 mL,DH-BMP中最高的產CH4量達到了201 mL.
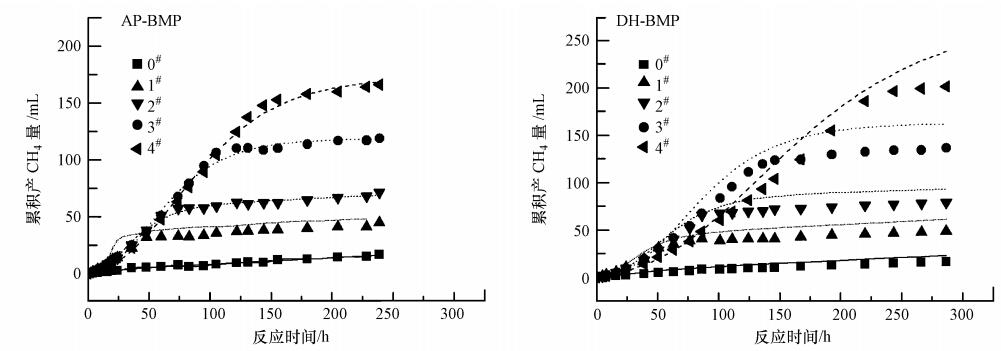
圖 1 實測CH4累積產氣量與回歸曲線
應用改進的Gompertz模型對AP-BMP、DH-BMP產氣進行回歸后的參數如表 2所示.兩廠的厭氧污泥產氣數據與改進的Gompertz模型擬合較好(R2>0.99).通常厭氧消化過程中的限速步驟為水解破壁過程(Noike et al., 1985),在無添加外來基質的0#樣品中,AP、DH厭氧污泥的遲滯期分別為13.56、0 h,表明DH厭氧污泥的活性較高.投加基質NaAc對厭氧污泥具有一定的抑制作用,且抑制作用隨基質濃度的提高而提升.DH厭氧污泥4#條件下遲滯期達到48.80 h,可能與4#樣品中S/X最高(0.67)有關.Prashanth等(2006)指出,較高的S/X比造成的氨氮和揮發酸的積累,對厭氧菌群產生一定的抑制作用,通常較低S/X值下的遲滯期較短(Chen et al., 1996).而在AP-BMP實驗中,無添加基質的0#的遲滯期達到了13.56 h,高于添加添加基質的1#、2#.這可能是由于AP厭氧污泥的反應活性較差,在無基質添加條件下需調整造成的.
表 2 改進Gompertz模型回歸BMP實驗參數
采用Michaelis-Menten模型對兩個批次實驗的基質濃度、比產氣速率進行回歸分析后的結果如圖 2所示(R2>0.99).由圖可知,AP、DH厭氧污泥的最大比產氣速率差距不大,分別為67.93、62.65 mL · g-1 · d-1(以VSS計),但兩廠厭氧污泥的Km存 在著顯著的差異,DH厭氧污泥的Km為801 mg · L-1,而AP厭氧污泥的Km高達1517 mg · L-1.Km是表征底物親和力的常數,表明AP厭氧污泥對基質NaAc的適應性差,需要在較高的基質濃度下才能表現出較好的產CH4性能.
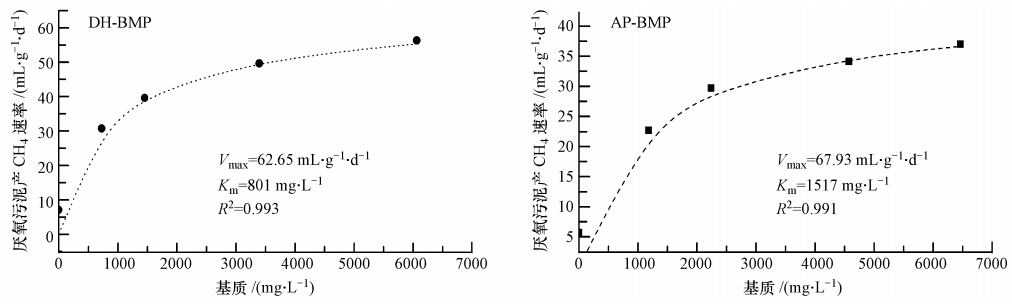
圖 2 Michaelis-Menten模型回歸BMP產CH4速率參數
3.2 水質變化分析
AP-BMP、DH-BMP兩個批次實驗結束時,不同S/X條件下的水質狀況如表 3所示.兩個批次實驗中隨著S/X增大,pH由弱酸性漸變為弱堿性,分別位于在6.5~7.8、6.7~7.8范圍內.0#呈弱酸性,可能由未添加基質、厭氧污泥自身的水解造成.DH-BMP與AP-BMP實驗結束時,ORP值分別位于-245~-327 mV與-310~-373 mV范圍內.隨著S/X比的增大,兩個批次實驗的ORP值都呈下降的趨勢.厭氧環境的主要標志是發酵液具有低的ORP,不同的厭氧消化體系和不同的厭氧微生物對ORP的要求不同.通常中溫厭氧消化系統要求的ORP應位于-300~-380 mV之間,產CH4菌最適宜的ORP為-350 mV或更低.DH-BMP實驗樣品的ORP明顯低于對應的AP-BMP實驗樣品值,表明DH-BMP中形成了良好的厭氧生化條件,厭氧污泥的活性高.
表 3 BMP實驗末期不同S/X條件下主要水質
兩批次實驗中在高S/X條件下溶解性COD(CODs)顯著下降,實驗結束時CODs基本相同,而未添加外來基質的0#樣品中CODs有所提高,可能是厭氧微生物內源代謝導致酸化水解從而造成CODs的提高.批次實驗前后,NH3-N濃度均有提高,不同S/X條件下NH3-N變化差異不大,其原因為有機氮的氨化作用造成NH3-N含量的提高,而外來基質NaAc的添加對有機氮的降解影響不大.在低S/X條件下(0#),兩厭氧污泥實驗結束后VSS/TSS降低,原因可能為厭氧污泥進行內源代謝,導致VSS/TSS降低.而在高S/X比條件下,VSS/TSS略有提高這可能是由于厭氧微生物生長緩慢,而實驗持續時間較短造成.
CH4回收率表示該實驗中生成CH4的COD還原值與實驗前后COD降低值的比值.AP-BMP中隨著S/X的增大,CH4回收率也隨之提高,但最高回收率只有52%.其原因推測為AP厭氧污泥中產CH4菌的濃度低、活性差,基質以其它的形式代謝.DH-BMP中1#、2#樣品的CH4回收率接近100%,可能由DH厭氧污泥中產CH4菌代謝活躍造成,0#樣品由于未添加基質,CH4回收率為43%,主要進行微生物的內源代謝,3#、4#樣品中CH4回收率在80%以上,均高于AP-BMP實驗中的對應回收率.
3.3 厭氧污泥生物多樣性分析
如圖 3所示,兩廠的厭氧污泥中產CH4菌的組成存在著一定的差異.AP廠厭氧消化池中的厭氧污泥Diverse菌群相對豐度達45%,產CH4功能菌主要以產CH4髦毛菌Methanosaeta spp.(280 bps)為主,同時存有少量的產CH4微菌Methanomicrobiaceae(80 bps)、RC-I(389 bps)和產CH4桿菌Methanobacteriaceae(88 bps).同時,DH厭氧消化池中的厭氧污泥產CH4功能菌相對豐度高,Diverse菌群相對豐度僅為7%.產CH4功能菌主要以產CH4髦毛菌Methanosaeta spp.(280 bps)為主,同時存在產CH4微菌Methanomicrobiaceae(80 bps)、RC-I(389 bps)和產CH4桿菌Methanobacteriacea(88 bps).DH污水廠的進水是由完整的市政下水道收集的生活污水,污水中有機含量高,可生化降解性能強,為厭氧消化提供了良好的條件,從而造成了DH厭氧消化池中厭氧污泥產CH4功能菌群豐度較高.
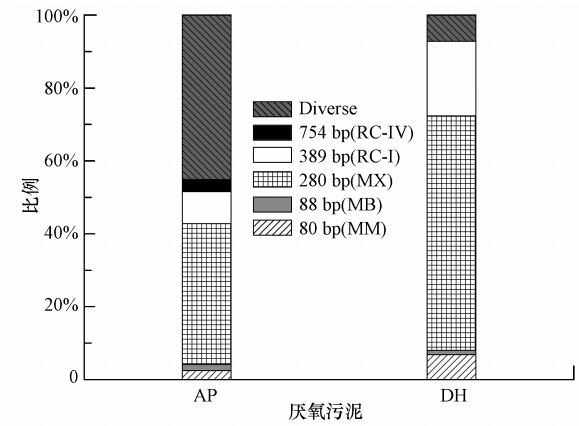
圖 3 AP、DH厭氧污泥中主要T-RFs豐度對比
3.4 SEM鏡檢結果
SEM鏡檢AP、DH厭氧污泥結果如圖 4所示.AP厭氧污泥鏡檢中發現了較為稀疏的髦毛菌,同時還存在著1~2 μm的短桿菌、7~10 μm的長桿菌和直徑為2 μm的產CH4微粒菌.這些菌群較為分散,菌群間的協同作用不強.DH厭氧污泥菌群與AP污泥相比豐富多樣,在基質上依附著大量的髦毛菌,與T-RFLP檢測的結果較為吻合.同時還存在著1~2 μm的短桿菌、7~10 μm的長桿菌和雙疊球菌等常見的產CH4菌.這些產CH4菌互相交錯、依賴形成了豐度較高的產CH4菌群,與DH厭氧污泥實驗的較佳的產CH4活性相吻合.具體參見污水寶商城資料或http://www.jianfeilema.cn更多相關技術文檔。

圖 4 AP和DH厭氧污泥SEM鏡檢
4 結論
1)AP、DH兩厭氧污泥采用改進的Gompertz模型回歸的最大比產氣速率數值接近,分別達到了67.93、62.65 mL · g-1 · d-1(以VSS計),但對基質NaAc的半飽和常數Km差異較大,分別為1517和801 mg · L-1,DH厭氧污泥對基質的親和力高.
2)BMP實驗最終的水質變化表明,DH-BMP厭氧污泥中的ORP位于-310~-373 mV之間,低于AP-BMP樣品中對應的ORP.在投加基質的條件下,DH厭氧污泥的CH4回收率高于80%,高于AP厭氧污泥的CH4回收率.在高S/X條件下,BMP實驗結束后VSS/TSS略有提高.
3)兩厭氧污泥T-RFLP和SEM鏡檢結果與其生化產CH4勢較為吻合,AP厭氧污泥中產CH4功能菌菌群稀疏且Diverse菌群相對豐度達45%,而DH厭氧污泥中產CH4功能菌種群密集,Diverse菌群豐度僅為7%.DH厭氧污泥中產CH4功能菌以產CH4髦毛菌Methanosaeta spp.(280 bps)為主,同時存在產CH4微菌Methanomicrobiaceae(80 bps)、RC-I(389 bps)和產CH4桿菌Methanobacteriacea(88 bps).
4)大量剩余污泥的產生是活性污泥工藝面臨的一個重要問題.后續可采用剩余污泥為基質,采用BMP的實驗方法,考察污泥消化減量過程中產氣性能、產甲烷功能菌群的動態變化及水質變化情況,為剩余污泥厭氧消化工藝性能優化提供基礎數據.