制漿造紙廢水是我國水體污染重要污染源之一。紙機白水是制漿造紙工業的一類重要廢水,其特點是水量大、懸浮物含量高、難降解有機物含量高(以木素和纖維素為主)。在白水的處理技術中,主要有物理化學法和生化法。在實際應用中,往往是將上述兩種方法結合使用,在生化后往往需要物化技術進行深度處理。在各類物化技術中,高級氧化技術,尤其是Fenton氧化技術在處理造紙廢水方面取得了明顯成效。賈金平等采用Fenton法處理造紙廢水中難降解物質、色度和COD,去除效果明顯。筆者試驗利用新型Fenton試劑處理紙機白水的生化出水,考察了初始pH、FeSO4投加量、H2O2投加量以及MnO2的催化氧化對色度和COD去除效果的影響,以期降低處理成本,為工程運用提供依據。
1 試驗部分
1.1 試驗廢水水質
試驗廢水取自山東某造紙廠紙機白水處理工藝的生化出水,主要水質指標為:COD 110~190 mg/L,色度16~20倍,電導率1 725~2 100 μS/cm,pH 7~8。
1.2 試劑和儀器
試劑:FeSO4·7H2O、30%H2O2、濃硫酸、CaO等藥品均為分析純,天津北海藥品有限公司。儀器:JJ-4六聯電動攪拌機(江蘇省金壇市醫療儀器廠),PHS-3C精密pH計(德國sartorius),BS/BT系列電子分析天平(德國sartorius),DRB200COD加熱器(美國HACH),HACH DR890便攜式分光光度計(美國HACH)。
1.3 試驗方法
量取若干份500 mL水樣置于1 L燒杯中,用30%硫酸調節pH,先投加FeSO4溶液,再加入H2O2溶液和MnO2粉末,混合攪拌1 h,用石灰調節pH至9~10,使Fe3+在堿性環境中快速水解,靜沉0.5h,取上清液分析,測定色度和COD。分別考察反應的初始pH、FeSO4投加量、H2O2的投加量、MnO2催化氧化對Fenton法處理廢水性能的影響。
1.4 分析方法
廢水的COD采用HACH COD測試儀(DRB200 COD加熱器、HACH DR890便攜式分光光度計)測定;廢水的色度采用稀釋倍數法測定。
2 結果和分析
2.1 Fenton試劑影響因素的優化
(1)初始pH對處理效果的影響。當進水COD=140 mg/L,色度20倍,FeSO4投加量為300 mg/L,30% H2O2投加量為0.6 mL/L時,通過向廢水中加硫酸調節pH。考察初始pH對COD和色度的去除情況的影響,結果如表 1所示。
| pH | COD/(mg.L -1 ) | COD去除率/% | 色度/倍 | 色度去除率/% |
| 2.0 | 103 | 26.4 | 20 | 0 |
| 2.5 | 100 | 28.5 | 16 | 20 |
| 3.0 | 60 | 57.0 | 4 | 80 |
| 4.0 | 87 | 37.9 | 12 | 40 |
| 5.0 | 98 | 30.0 | 16 | 20 |
由表 1可見,在pH=3.0時,有機物與色度的去除效果都最好,COD能降到60mg/L,色度降到4倍,符合《制漿造紙工業水污染物排放標準》(GB 3544—2008)。因為Fe2+在溶液中的存在形式受制于溶液的pH,所以Fenton試劑只在酸性條件下發生作用,在中性和堿性環境中,Fe2+不能催化H2O2產生·OH。S.H.Lin等在采用Fenton試劑處理紡織廢水時發現pH增加并超過3.0時,廢水中的COD迅速升高,故pH為3.0時是最佳點。試驗驗證了Fenton試劑處理廢水的最適的初始pH為3.0,較高或較低的pH都影響有機物和色度的去除。
(2)FeSO4投加量對處理效果的影響。當進水COD=186 mg/L,色度20倍,調節pH=3.0,30% H2O2投加量為0.6 mL/L,投入不同體積的FeSO4溶液來改變Fe2+的濃度,考察FeSO2投加量對COD和色度去除情況的影響,結果如表 2所示。
表 2 FeSO 4 投加量對廢水COD、色度去除的影響| FeSO 4 投加量/(mg.L -1 ) | COD/(mg.L -1 ) | COD去除率/% | 色度/倍 | 色度去除率/% |
| 50 | 174 | 6.9 | 10 | 50 |
| 100 | 114 | 38.7 | 8 | 60 |
| 150 | 79 | 57.5 | 5 | 75 |
| 200 | 63 | 66.1 | 4 | 80 |
| 300 | 53 | 71.5 | 4 | 80 |
由表 2可見,催化劑Fe2+濃度較小時,不利于催化反應的進行,導致整個Fenton試劑的鏈式反應速度慢,產生的·OH的量較少,從而影響有機物色度的去除。在低濃度范圍內,通過增加Fe2+濃度,有機物和色度的去除都有所提高。但在150 mg/L以后,增加FeSO4投加量,COD和色度的去除效果趨于緩慢,不明顯。當FeSO4投加量為300mg/L時,COD降到60mg/L以下,去除率達到71.5%,色度降到4倍,去除率達到80%。
(3)H2O2投加量對處理效果的影響。當進水COD=170 mg/L,色度20倍,調節pH=3.0,FeSO4投加量為300 mg/L 時,投加不同體積30% H2O2來改變H2O2的濃度,考察H2O2投加量對COD和色度去除情況的影響,結果如表 3所示。
表 3 H 2 O 2 投加量對廢水COD、色度去除的影響| H 2 O 2 投加量/(mg.L -1 ) | COD/(mg.L -1 ) | COD去除率/% | 色度/倍 | 色度去除率/% |
| 0.1 | 85 | 50.0 | 6 | 70 |
| 0.2 | 72 | 57.6 | 4 | 80 |
| 0.4 | 65 | 61.7 | 4 | 80 |
| 0.5 | 60 | 64.7 | 4 | 80 |
| 0.6 | 51 | 70.0 | 3 | 85 |
由表 3可見,H2O2投加量為0.4 mL/L,出水COD從降至65 mg/L,色度降至4倍,去除效果明顯。繼續增加H2O2投加量至0.5 mL/L,COD和色度的去除效果提高不明顯。這是因為當H2O2用量增到一定程度,使得·OH 生成速率和·OH被H2O2消耗生成HO2·的速率幾乎相等,此時再增加H2O2用量,其對羥基自由基的捕捉作用隨之增加,使得氧化發色體的·OH大量被消耗,溶液中·OH的生成速率反而降低,總反應速度反而減緩。
2.2 MnO2催化氧化對處理效果的影響
(1)MnO2投加對處理效果的影響。當進水COD=170 mg/L,色度20倍,調節pH=3.0,FeSO4投加量為200 mg/L,反應中投加0.3 g/L MnO2,投加不同體積30% H2O2來改變H2O2的濃度,考察類Fenton反應中H2O2投加量對COD去除情況的影響,結果如圖 1所示。
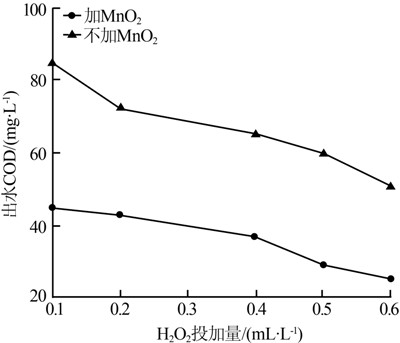
由圖 1可見,對應不同的H2O2投加量,MnO2的投加都可提高Fenton試劑對廢水中COD的去除效果。另外還可見,當出水COD都達到45 mg/L時,傳統Fenton試劑需要投加0.6 mL/L的H2O2,而加入MnO2后,H2O2的投加量可以減少至0.1mL/L。這是因為錳氧化物通過吸附、氧化偶合或氧化分解等方式與多種有機物相互作用,可進一步去除廢水中COD。且在Fenton反應體系中,鐵錳過渡金屬均對H2O2有催化作用,提高H2O2的利用效率。
(2)MnO2投加時段對處理效果的影響。當進水COD=129 mg/L,色度20倍,調節pH=3.0,FeSO4投加量為200 mg/L,30% H2O2投加量為0.5 mL/L時,考察Fenton反應不同時段投加0.3 g/L MnO2對COD去除情況的影響。結果表明:在反應開始前投加MnO2去除COD效果稍差于反應中(反應0.5 h)和反應結束時(反應1 h)投加,這是因為在利用Fenton試劑處理廢水試驗時,n(H2O2)∶n(Fe2+)>1才有很好的處理效果,此時反應體系中還有殘留的H2O2未有效利用,反應0.5 h后投加的MnO2能催化氧化該部分H2O2,從而提高Fenton試劑對有機物的去除效果。
(3)投加MnO2對COD去除率的影響,當進水COD=138 mg/L,色度20倍,調節pH=3.0,FeSO4投加量為200 mg/L,30% H2O2投加量為0.5 mL/L,考察投加MnO2與不投加MnO2對COD去除率的影響,結果如圖 2所示。
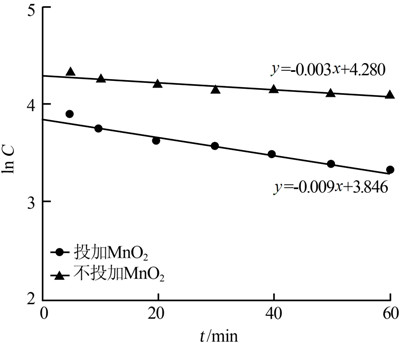
由圖 2可見,投加MnO2反應速率為0.009,是不投加MnO2的3倍,去除COD明顯快于一般Fenton反應。這是由于MnO2的催化作用,更高效地利用了H2O2去除有機物。具體參見http://www.jianfeilema.cn更多相關技術文檔。
(4)MnO2循環利用次數對處理效果的影響。當進水COD=136 mg/L,色度20倍,調節pH=3.0,FeSO4投加量為200 mg/L,30% H2O2投加量為0.5 mL/L。第一次Fenton反應投加新鮮0.3 g/L MnO2,第二次投加的MnO2是從第一次反應結束時廢液中提取出的,第三次投加MnO2類比第二次進行。考察循環次數對COD去除情況的影響,試驗結果表明:前三次的MnO2循環利用對Fenton試劑作用影響變化不大,均能有效提高對COD的去除。因此,在實際的工程應用中,MnO2可以作為催化劑反復使用。
3 結論
(1)Fenton法處理紙機白水的生化出水最佳試驗條件:pH=3.0,FeSO4投加量為300 mg/L,30% H2O2投加量為0.5mL/L,反應1h,COD降至60mg/L以下,去除率達到64%,色度降至4倍,出水水質達到制漿造紙行業國家規定排放標準,具有回用價值。
(2)在Fenton試劑反應中投加MnO2只起催化作用,可提高對COD去除速率。且在達到相同的去除率時,H2O2使用量只有不投MnO2情況下的一半。


