電鍍、不銹鋼制造等工業廢水的排放是Cr(Ⅵ)的主要來源之一。Cr(Ⅵ)毒性大、溶解性好、遷移性強,且重金屬污染物與其他污染物不同,在水體中難以被降解消除。水體中的Cr(Ⅵ)可通過地表徑流和生物富集的方式進行擴散,進入人體后有致癌、致畸、致突變風險,長期暴露在Cr(Ⅵ)污染環境中將對人體健康產生嚴重威脅。
施氏礦物是在富含Fe2+、SO42-等離子的酸性礦山廢水中發現的一種次生羥基鐵礦物,因其具有較高的比表面積及富含·OH、SO42-等優點,被廣泛應用于水體中Cr(Ⅵ)的去除。但生物合成法制備施氏礦物過程長、步驟復雜,因此難以大規模應用,過氧化氫快速氧化法合成的施氏礦物比表面積小、微孔結構不明顯;同時施氏礦物結晶度差,礦物相易隨外界酸堿環境變化而發生轉變,造成吸附的重金屬離子二次釋放。基于此,筆者在施氏礦物中嵌入CaSiO3合成了一種類施氏礦物,合成過程中可同步去除工業廢水中的Cr(Ⅵ),并考察反應物濃度、共存離子濃度等因素對類施氏礦物除Cr(Ⅵ)的影響,旨在為處理含Cr(Ⅵ)工業廢水提供借鑒和參考。
1、材料與方法
1.1 類施氏礦物除Cr(Ⅵ)影響因素試驗
稱取0.283g的K2Cr2O7于燒杯中,加入適量去離子水,用玻璃棒攪拌至固體完全溶解,轉移至1L容量瓶中定容至標線,得到濃度為100mg/L的Cr(Ⅵ)模擬廢水。通過單因素試驗,探究反應物投加量、溫度、pH、共存離子濃度、絡合劑濃度對類施氏礦物去除Cr(Ⅵ)的影響。取250mL含Cr(Ⅵ)模擬廢水于500mL錐形瓶中,按表1配比加入FeSO4·7H2O、H2O2、Na2SiO3、CaCl2,置于恒溫水浴振蕩器中,保持轉速為150r/min進行10min搖瓶試驗,以確定最佳反應物投加量。
采用最佳反應物投加量,分別在15、20、25、30、35℃條件下進行10min搖瓶試驗(轉速為150r/min),確定最佳反應溫度。將模擬廢水初始pH分別設定為2.0、3.5、5.0、6.5、7.5后,在最佳溫度下進行搖瓶試驗,其他條件與上述試驗一致。調節模擬廢水pH至最佳,按照物質的量之比為1∶2∶1加入NaCl、MgCl2、KCl,配制共存離子(Na+、Mg2+、K+)濃度分別為20、40、60、80、100mmol/L的模擬廢水,在最佳反應物投加量、最佳溫度下進行搖瓶試驗,其他條件同上,分析共存離子濃度對類施氏礦物去除Cr(Ⅵ)的影響。在配水中加入EDTA-2Na,配制絡合劑濃度分別為0.5、1、2、4、8mmol/L的模擬配水,在最佳反應物投加量、最佳溫度、最佳初始pH下進行搖瓶試驗,其他條件同上,分析絡合劑濃度對去除Cr(Ⅵ)的影響。
各單因素試驗均在反應后1、2、4、6、8、10min取樣,過0.45μm濾膜,取上清液測定pH、總Fe、SO42-、Ca2+、SiO32-和Cr(Ⅵ)的濃度。
1.2 礦物的制備
在250mL去離子水中加入5.56g/L的FeSO4·7H2O、3mL的H2O(230%),保持28℃、150r/min的條件,并在恒溫水浴振蕩器中進行24h的合成試驗。向含Cr(Ⅵ)的廢水中投加施氏礦物粉末,以同樣的方法合成含Cr(Ⅵ)的施氏礦物。
分別取250mL去離子水和模擬廢水于500mL錐形瓶中,采用最佳投量加入FeSO4·7H2O、H2O2、Na2SiO3、CaCl2,其他條件同上。反應后1、2、4、6、8、10min取樣過濾,得到不同時段合成的類施氏礦物和含Cr(Ⅵ)類施氏礦物固體。
上述合成的固體礦物樣品均采用抽濾分離,濾渣置于烘箱內(65℃)烘至恒質量,經研磨過篩后備用,采用相關設備對其結構進行表征。
1.3 類施氏礦物和施氏礦物去除Cr(Ⅵ)的效能
取1L含Cr(Ⅵ)模擬廢水于燒杯中,在最佳反應條件下加入11.12g的FeSO4·7H2O、6.66g的H2O2、8.53g的Na2SiO3、4.44g的CaCl2,保持650r/min的轉速于磁力攪拌器上進行去除Cr(Ⅵ)的試驗,在1、2、4、6、8、10min取樣過濾,測試上清液中Cr(Ⅵ)濃度。保持相同的試驗條件,在含Cr(Ⅵ)模擬廢水中加入1g施氏礦物進行12h的吸附試驗,每隔1h取樣測定Cr(Ⅵ)濃度,對比類施氏礦物和施氏礦物去除Cr(Ⅵ)的效能。
在1L聚乙烯廣口瓶中加入1L去離子水,向其中分別加入1g含Cr(Ⅵ)的類施氏礦物和含Cr(Ⅵ)的施氏礦物,常溫靜置,定期取樣測定上清液中Cr(Ⅵ)濃度,觀察40d內Cr(Ⅵ)的溶出情況。
1.4 檢測項目及方法
SO42-采用鉻酸鋇分光光度法測定;總Fe采用鄰菲啰啉分光光度法測定;Cr(Ⅵ)采用火焰原子吸收法測定;Ca2+采用原子吸收分光光度法測定;SiO32-采用鉬硅黃分光光度法測定;比表面積采用激光粒度分析儀測定;施氏礦物和類施氏礦物采用場發射掃描電子顯微鏡(SEM)、X射線粉末衍射儀(XRD)、紅外光譜儀(FT-IR)進行表征。
2、結果與討論
2.1 反應物濃度對類施氏礦物去除Cr(Ⅵ)的影響
不同反應物濃度下pH的變化如圖1所示。
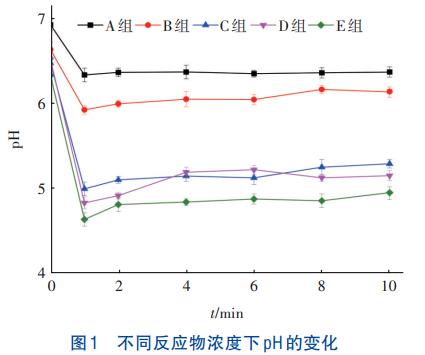
由圖1可知,pH在反應開始1min內急劇下降至最低值。分析原因,反應開始后,溶液中的Fe3+與SO42-反應合成了類施氏礦物,并產生了大量H+,見式(1),引起pH急劇下降;之后pH趨于穩定,可能是由于SiO32-發生水解反應中和H+所致。
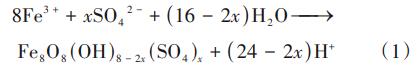
在反應物初始濃度由11.54g/L增至30.75g/L條件下,pH降幅由7.68%~8.52%增加至21.80%~26.78%。分析是由于隨著初始反應物濃度的增加,單位體積內Fe3+與SO42-含量增加,有效促進了類施氏礦物的合成,增加了H+產量。
不同反應物濃度下總Fe、SO42-、Ca2+、SiO32-濃度的變化如圖2所示。可知,溶液中的總Fe、SO42-、Ca2+、SiO32-濃度均在反應開始1min內迅速下降,FeSO4·7H2O在H2O2的催化下快速產生了Fe3+,Fe3+在短時間內與SO42-、Cr(Ⅵ)反應形成含鉻礦物沉淀;同時,SiO32-與Ca2+碰撞形成CaSiO3嵌合在礦物中。因此,各離子濃度均急劇下降,之后濃度趨于平穩是由于合成類施氏礦物反應逐漸達到平衡。

反應物濃度對去除Cr(Ⅵ)的影響如圖3所示。可知,Cr(Ⅵ)濃度在反應開始1min內由100mg/L急劇下降至0.85~6.34mg/L,絕大部分Cr(Ⅵ)被去除,之后Cr(Ⅵ)濃度呈上升趨勢。結合上述分析可知,類施氏礦物在合成過程中會產生大量H+,酸性環境導致類施氏礦物孔道溶解或結構發生改變,因此Cr(Ⅵ)重新溶出。
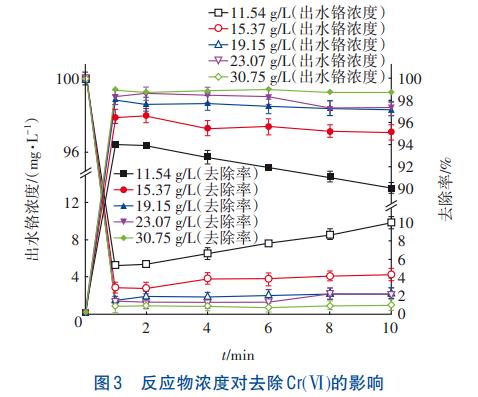
當反應物初始濃度由11.54g/L增至30.75g/L時,Cr(Ⅵ)去除率由89.12%~94.66%增至98.99%~99.15%。這是由于初始反應物濃度增加后,Cr(Ⅵ)周圍的Fe3+與SO42-濃度增大,Cr(Ⅵ)與礦物接觸的幾率增大,去除效果增強;同時單位體積內Ca2+、SiO32-的活化分子數量增多,促進了Ca2+與SiO32-的有效碰撞,加速了CaSiO3與Cr(Ⅵ)的共沉淀。
2.2 溫度對類施氏礦物去除Cr(Ⅵ)的影響
溫度對去除Cr(Ⅵ)的影響表明,反應開始1min內,Cr(Ⅵ)濃度由100mg/L下降至1.68~3.14mg/L,不同溫度條件下Cr(Ⅵ)均基本被去除,之后緩慢上升。在溫度為15~35℃的條件下,Cr(Ⅵ)去除率由94.76%~96.86%增至97.74%~98.32%,溫度對去除Cr(Ⅵ)的影響微弱。這是由于Cr(Ⅵ)與類施氏礦物結合的化學鍵相對穩定,當反應物濃度相同時,合成的類施氏礦物量差距較小。
2.3 pH對類施氏礦物去除Cr(Ⅵ)的影響
初始pH不僅會影響礦物表面的帶電性和質子化程度,還會影響Cr(Ⅵ)在溶液中的存在形態。當初始pH為2.0~7.5時,反應開始1min后,Cr(Ⅵ)濃度迅速下降至0.44~7.16mg/L,之后回升至0.72~10.27mg/L。當系統初始pH由2.0增加至7.5時,Cr(Ⅵ)去除率由99.28%~99.56%降至89.73%~92.84%。初始pH升高以后,類施氏礦物表面的帶電基團由正電荷向負電荷轉變,從而對含氧陰離子Cr(Ⅵ)產生靜電斥力,影響了其與類施氏礦物的結合;pH的變化影響了Cr(Ⅵ)在溶液中的存在形態,見式(2)。HCrO4-、Cr2O72-、CrO42-在pH為3~8時共存,當溶液pH升高后,H2CrO4和HCrO4-發生電解反應轉變為Cr2O72-和CrO42-,而臨界基團≡Fe—O—對HCrO4-的親和力最高,吸附量最大;同時,pH升高會促進Fe3+和OH-生成Fe(OH)3,并覆蓋在類施氏礦物表面,抑制·OH產生,影響Cr(Ⅵ)的去除。
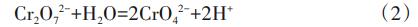
2.4 共存離子對類施氏礦物去除Cr(Ⅵ)的影響
Na+、K+等共存離子普遍存在于水體中,共存離子濃度增加會加速次生鐵礦的形成,且Na+、K+離子半徑與Fe3+、SO42-相似,反應過程中可能會占據礦物的吸附點位,影響對Cr(Ⅵ)的去除。共存離子濃度對類施氏礦物去除Cr(Ⅵ)的影響表明,Cr(Ⅵ)濃度在反應開始1min內下降至3.73~68.65mg/L,之后趨于平穩。當共存離子濃度為20~80mmol/L時,對Cr(Ⅵ)的去除率由95.16%~96.27%降至90.01%~90.36%;當共存離子濃度繼續增至100mmol/L時,對Cr(Ⅵ)的去除率降至30.65%~31.35%,共存離子濃度增大對類施氏礦物去除Cr(Ⅵ)存在抑制作用,且在80~100mmol/L區間更為顯著。推測原因是:一方面共存陽離子會與Fe3+形成競爭關系,影響類施氏礦物與Cr(Ⅵ)的結合,從而降低去除Cr(Ⅵ)的能力;另一方面共存離子增大到一定濃度時會加速Na+、K+與SO42-反應生成黃鐵礬礦,見式(3),抑制類施氏礦物的合成。
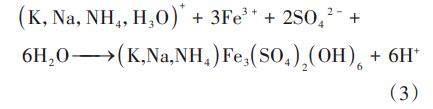
2.5 絡合劑對類施氏礦物去除Cr(Ⅵ)的影響
工業生產需投加一定量的絡合劑以滿足生產需求,絡合劑的分散、懸浮作用可能會影響礦物去除工業廢水中的重金屬。絡合劑濃度對類施氏礦物去除Cr(Ⅵ)的影響表明,Cr(Ⅵ)濃度在反應開始1min內迅速下降至2.48~24.69mg/L,之后趨于平穩。當絡合劑濃度由0.5mmol/L增至8.0mmol/L時,對Cr(Ⅵ)的去除率由97.52%~97.86%降至75.22%~75.33%。推測溶液中絡合劑EDTA-2Na與Fe3+、Ca2+發生絡合反應,影響類施氏礦物的合成,導致去除能力降低。
2.6 類施氏礦物去除Cr(Ⅵ)機理分析
2.6.1 礦物微觀結構分析
施氏礦物的SEM照片如圖4所示。可見,施氏礦物表面由光滑球形顆粒組成,直徑約為2.48~3.39μm,表面有一些突起,這與Xie等人的研究結果一致。相比于施氏礦物,含Cr(Ⅵ)的施氏礦物結構形態并未發生改變,這是因為Cr(Ⅵ)在施氏礦物上的結合機理主要包括靜電吸附、與表面·OH的絡合作用,以及與SO42-的交換作用,致使溶液中的Cr(Ⅵ)吸附在施氏礦物表面,故沒有影響施氏礦物的球形顆粒狀形態。

反應過程中類施氏礦物的SEM照片見圖5。可見,反應開始后1~4min內,礦物表面被大量細小的球狀顆粒覆蓋;6min之后,礦物表面開始出現長度為0.83~1.63μm、寬度為0.55~1.0μm的不規則塊狀礦物,可能是在合成過程中添加的Na2SiO3、CaCl2生成大量CaSiO3嵌合在類施氏礦物中所致。反應8min時,礦物表面的結晶顆粒密度增大,球狀特征不再清晰,且之后礦物穩定,推測類施氏礦物是在反應開始后的6~8min內合成的。

含Cr(Ⅵ)類施氏礦物的SEM照片見圖6。含Cr(Ⅵ)類施氏礦物表面為不規則的多邊形塊狀顆粒,表面光滑,且在反應1~10min內表觀結構基本未發生明顯變化,說明類施氏礦物能在1min之內快速去除Cr(Ⅵ),與上述分析結果一致。結合圖5的結果推斷,類施氏礦物是在合成過程中去除Cr(Ⅵ)的。

另外發現,含Cr(Ⅵ)類施氏礦物的長和寬較類施氏礦物分別多出0.24~0.60、0.21~0.33μm。分析原因:①類施氏礦物中的CaSiO3通過網捕作用將Cr(Ⅵ)離子固定在礦物的晶格中,同時溶液中的Cr(Ⅵ)與類施氏礦物發生共沉淀反應,Cr(Ⅵ)充實了礦物的晶體結構,導致類施氏礦物表觀發生明顯改變;②Cr(Ⅵ)與SO42-的離子半徑相當,所以類施氏礦物表面和隧道內部的SO42-很容易被含Cr(Ⅵ)陰離子取代,見式(4),溶液中的Cr(Ⅵ)被吸附在類施氏礦物表面,致使其本來具有的球狀顆粒不被觀察到。

相對于施氏礦物,類施氏礦物棍棒狀和細小的球狀顆粒表面為重金屬提供了更多的吸附點位,所以對Cr(Ⅵ)的去除水平遠遠優于施氏礦物。分析表明,類施氏礦物的比表面積為322.85m2/g,較施氏礦物的13.70m2/g增大了約23倍,也驗證了這一點。
2.6.2 礦物XRD分析
類施氏礦物和施氏礦物的XRD圖譜見圖7。可知,施氏礦物衍射峰為22.65°、35.42°、47.37°、55.23°、61.45°,與標準施氏礦物(JCPDS47-1775)一致。含Cr(Ⅵ)施氏礦物較施氏礦物峰值略有增加,說明吸附Cr(Ⅵ)后礦物的結晶度上升。二者的XRD圖譜均呈現較多毛刺,說明晶體結晶度差或是無定形礦物。

類施氏礦物的XRD圖譜在20.83°、27.31°、35.10°、41.13°、51.88°處出現與施氏礦物相近的衍射峰,說明類施氏礦物部分晶體結構與施氏礦物相似。35.10°、51.88°處的衍射峰出現偏移,且衍射峰較窄,與礦物中CaSiO3的嵌入導致礦物晶相出現一定程度的變化有關。嵌合的CaSiO3可以提高礦物的穩定性,為溶液中的Cr(Ⅵ)提供了更多的吸附點位,提高了類施氏礦物對Cr(Ⅵ)的去除效果。此外,類施氏礦物在11.52°、29.51°處出現了CaSiO3的衍射峰,表明類施氏礦物是在合成施氏礦物的基礎上嵌合硅酸鈣生成的一種新型礦物。含Cr(Ⅵ)類施氏礦物衍射峰相對于類施氏礦物沒有出現新的峰位。Cr(Ⅵ)是通過離子交換、靜電吸附等方式與類施氏礦物表面的SO42-絡合,因此不影響礦物的隧道結構和晶型。但是含Cr(Ⅵ)類施氏礦物在27.31°、41.13°處的衍射峰比類施氏礦物分別高出96、127cps,這是由于Cr(Ⅵ)通過共沉淀作用進入類施氏礦物晶格中,增強了礦物的結晶度所致。
2.6.3 礦物FT-IR分析
礦物的紅外光譜如圖8所示。可以看出,含Cr(Ⅵ)施氏礦物、含Cr(Ⅵ)類施氏礦物的SO42-吸收峰透過率分別比施氏礦物、類施氏礦物增加了17.17%、32.02%。Cr(Ⅵ)的離子半徑與SO42-相近,吸附過程中其與施氏礦物表面的SO42-發生離子交換或表面絡合反應,從而導致施氏礦物中的SO42-減少。
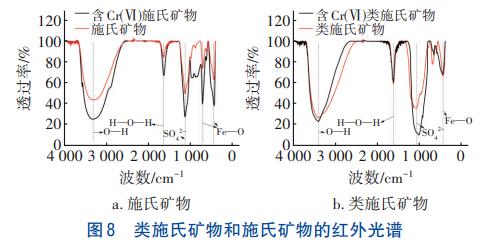
含Cr(Ⅵ)類施氏礦物的O—H吸收峰透過率較類施氏礦物增加了4.29%,表明類施氏礦物結合Cr(Ⅵ)后基團含量減少。推測原因是類施氏礦物表面的羥基基團與重金屬離子進行配位絡合,促使重金屬離子進入礦物雙電層的sterm層,通過形成的內層絡合物去除Cr(Ⅵ),由此導致O—H含量減少。含Cr(Ⅵ)類施氏礦物的SO42-吸收峰透過率比類施氏礦物增加了25.30%,這是SO42-與溶液中的Cr(Ⅵ)在合成礦物時發生離子交換和共沉淀作用所致。類施氏礦物的O—H特征峰和SO42-吸收峰均呈明顯的溝壑狀,透過率較施氏礦物分別降低了5.71%、29.95%,表明類施氏礦物含有更多的羥基和硫酸根基團,因此對Cr(Ⅵ)的去除能力增強。
2.7 類施氏礦物和施氏礦物去除效能對比
保持溫度為35℃、pH為2.0、共存離子濃度為20mmol/L、絡合劑濃度為0.5mmol/L,試驗結果表明,類施氏礦物溶液中Cr(Ⅵ)在1min內由100mg/L降至最低值,去除率為97.7%,之后趨于穩定。施氏礦物在反應12h后達到最大去除率47.98%,較類施氏礦物下降49.72%。施氏礦物合成及處理時間較長,而類施氏礦物可以在1min內將Cr(Ⅵ)基本去除,且去除效能顯著優于施氏礦物。
2.8 類施氏礦物和施氏礦物的穩定性
類施氏礦物溶液中的Cr(Ⅵ)濃度在1d時上升至0.37mg/L,之后趨于穩定,Cr(Ⅵ)的溶出率為1.16%,表明類施氏礦物能高效固定Cr(Ⅵ)。推測原因:①類施氏礦物通過CaSiO3的網捕作用將Cr(Ⅵ)穩定地固定在礦物固相中,不易發生后沉淀現象;②通過共沉淀作用去除的Cr(Ⅵ)被吸附在類施氏礦物內,導致Cr(Ⅵ)無法溶出;③Cr(Ⅵ)可能會生成(Crx,Fe1-x)(OH)3等化合物,增加了類施氏礦物的吸附穩定性。
同時發現,1d內施氏礦物溶液中的Cr(Ⅵ)濃度升至0.13mg/L,之后趨于穩定,Cr(Ⅵ)的溶出率為28.39%,較類施氏礦物增加27.23%,存在Cr(Ⅵ)的二次污染。這是因為施氏礦物主要是通過靜電吸附或離子交換作用將溶液中的重金屬吸附在礦物表面,經過長時間浸泡后,施氏礦物表面電位發生變化,致使通過靜電吸附作用去除的Cr(Ⅵ)脫附,同時溶液中游離的Fe3+與Cr(Ⅵ)發生離子交換,也促使溶液中Cr(Ⅵ)濃度升高。
3、結論
①共存離子濃度和絡合劑濃度增大均會顯著抑制Cr(Ⅵ)的去除。當共存離子濃度為100mmol/L時,對Cr(Ⅵ)的去除率可以降至30.65%~31.35%;當絡合劑濃度為8.0mmol/L時,對Cr(Ⅵ)的去除率僅為75.22%~75.33%。初始反應物濃度、溫度、初始pH對Cr(Ⅵ)的去除影響不明顯。
②合成類施氏礦物的最佳反應條件是溫度為35℃、pH為2.0、共存離子濃度為20mmol/L、絡合劑濃度為0.5mmol/L,此時對Cr(Ⅵ)的最高去除率為97.7%,較施氏礦物提高了49.72%。
③含Cr(Ⅵ)類施氏礦物溶液中Cr(Ⅵ)濃度在1d內上升至0.37mg/L,Cr(Ⅵ)溶出率為1.16%,較施氏礦物降低了27.23%。
④類施氏礦物可以通過靜電吸附、離子交換等方式吸附重金屬,并能通過CaSiO3的網捕和共沉淀作用將重金屬固定在礦物的晶格內,從而可在合成過程中高效去除廢水中的Cr(Ⅵ)。(來源:廣州大學土木工程學院,廣州市市政集團有限公司,生態環境部華南環境科學研究所,廣州市北控環保工程有限公司)



