1 引言(Introduction)
水環境中的重金屬污染已經成為一個日益突出的環境問題, 尤其是工業廢水和城市污水等造成的重金屬污染具有長期性和不可逆的特點.微生物對重金屬具有良好的吸附和轉化作用, 可以將其從廢水中去除, 達到治理污染、回收重金屬和處理后水體回用的目的.近30年來, 國內外的科研工作者對重金屬廢水的微生物吸附處理技術開展了較廣泛的研究, 已發現的用于重金屬離子吸附的微生物數量眾多, 主要由細菌、真菌和藻類組成.研究表明, 吸附劑的性能主要由生物量的特性、目標重金屬的物理化學性質及反應發生的小環境等因素決定.研究微生物吸附劑對重金屬的吸附特性, 對于凈化重金屬污染環境具有重要的理論和實際意義.
現有研究多集中于單一重金屬離子的生物吸附作用, 而對多組分重金屬離子的同時吸附過程研究不多.由于重金屬離子的復雜性, 多種金屬共存時的聯合作用會改變其被吸附性, 研究表明, 共存重金屬對于微生物吸附目標離子存在促進作用、抑制作用或蒸餾效應等.鑒于此, 本研究采用課題組前期工作中分離得到的銅綠假單胞菌(Pseudomonas aeruginosa)為實驗菌株, 考察其對水體中Cu2+和Pb2+的去除效果及其影響因素, 分析2種重金屬共存條件下菌體對目標重金屬的吸附能力變化, 研究微生物對復合重金屬的吸附效應, 以期為重金屬場地的微生物修復提供理論依據.
2 材料與方法(Materials and methods) 2.1 實驗試劑與材料 2.1.1 實驗試劑
牛肉膏、蛋白胨、NaCl、Cu(NO3)2、Pb(NO3)2等購自上海化學試劑廠, 均為AR級.1000 mg·L-1Cu2+和Pb2+母液分別由Cu(NO3)2和Pb(NO3)2溶于高純水得到.
2.1.2 菌株與培養基
菌株:由本課題組從受污染嚴重的蘇州市原江蘇化工農藥集團地塊土壤中篩選得到, 經16S rDNA序列比對, 鑒定為銅綠假單胞菌(P. aeruginosa).營養培養基:牛肉膏3 g, 蛋白胨10 g, NaCl 5 g, 蒸餾水1000 mL, pH值為7.2~7.4;培養基在121 ℃下滅菌30 min.
2.2 實驗方法 2.2.1 菌株培養
接種P. aeruginosa于培養液中, 于(30±1) ℃、150 r·min-1搖床中振蕩培養24 h.取菌液按1%體積比接種于新鮮培養液中, 在上述條件下培養24 h, 6000 r·min-1離心10 min獲取菌體, 用0.05 mol·L-1的磷酸緩沖液(pH=7.3) 清洗菌體3次, 備用.
2.2.2 不同因素對P. aeruginosa吸附Cu2+和Pb2+的影響
吸附時間的影響:于pH=7.0的純水體系中加入一定量的P. aeruginosa菌懸液, 投菌量為1 g·L-1;再向體系中加入一定量的Cu(NO3)2和Pd(NO3)2溶液, 使體系中重金屬離子濃度分別為1 mg·L-1 Cu2+、1 mg·L-1Pb2+和1 mg·L-1Cu2++1 mg·L-1 Pb2+, (30±1) ℃下置于150 r·min-1恒溫搖床中處理0、0.5、1、2、4、8、12 h后取樣;樣品轉入離心管, 于6000 r·min-1離心10 min, 取上清液測定重金屬濃度.
投菌量的影響:于pH=7.0的純水體系中加入一定量的P. aeruginosa菌懸液, 投菌量分別為0.1、0.25、0.5、1、2 g·L-1;再向體系中加入一定量的Cu(NO3)2和Pd(NO3)2溶液, 使體系中重金屬離子濃度分別為1 mg·L-1Cu2+、1 mg·L-1Pb2+和1 mg·L-1Cu2++1 mg·L-1Pb2+, (30±1) ℃下置于150 r·min-1恒溫搖床中處理2 h后取樣, 測定2種重金屬的濃度.
pH的影響:分別于pH=3.0、4.0、5.0、6.0、7.0和8.0的純水體系中加入一定量的P. aeruginosa菌懸液, 投菌量為1 g·L-1;再向體系中加入一定量的Cu(NO3)2和Pd(NO3)2溶液, 使體系中重金屬離子濃度分別為1 mg·L-1Cu2+、1 mg·L-1Pb2+和1 mg·L-1Cu2++1 mg·L-1Pb2+, (30±1) ℃下置于150 r·min-1恒溫搖床中處理2 h后取樣, 測定2種重金屬的濃度.
2.2.3 重金屬共存下P. aeruginosa吸附性能
Pb2+共存下活菌對Cu2+的吸附:向含1 mg·L-1 Cu2+、pH=7.0的純水體系中加入一定量的P. aeruginosa菌懸液, 投菌量為1 g·L-1;再向體系中加入一定量的Pb(NO3)2溶液, 使體系中Pb2+濃度分別為1、2、5、8、10 mg·L-1, 于(30±1) ℃置于150 r·min-1恒溫搖床中處理2 h后取樣, 測定Cu2+的濃度.
Pb2+共存下戊二醛固定后菌體對Cu2+的吸附:取菌體配制成菌液, 用最終濃度為2.5%的戊二醛固定24 h后, 用雙蒸水清洗至pH中性.吸附實驗同同上.
Cu2+共存下菌體對Pb2+的吸附:體系中Pb2+濃度為1 mg·L-1, Cu2+濃度分別為1、2、5、8、10 mg·L-1, 吸附實驗同上, 測定Pb2+的濃度.
Cu2+共存下戊二醛固定后菌體對Pb2+的吸附:體系中Pb2+濃度為1 mg·L-1, Cu2+濃度分別為1、2、5、8、10 mg·L-1, 吸附實驗同上.
2.2.4 重金屬濃度測定
重金屬濃度利用火焰原子吸收分析儀進行測定.
2.2.5 吸附率和吸附量的計算
吸附率R和吸附量q的計算公式如下:
式中, c0和ce分別為吸附前后溶液中重金屬的濃度(mg·L-1), m為吸附劑用量(g), V為溶液總體積(L).
2.2.6 掃描電鏡(SEM)實驗
分別將空白菌體和吸附1 mg·L-1Cu2++1 mg·L-1Pb2+菌體進行脫水、冷凍干燥和噴金等前處理, 利用FEG 520型掃描電鏡觀察菌體形態.
2.3 數據分析
用SPSS13.0軟件對數據進行統計分析, 結果用平均值±標準差(Means±SD)表示.
3 結果與討論(Results and discussion) 3.1 處理時間對P. aeruginosa吸附Cu2+和Pb2+的影響
大多數有關重金屬生物吸附的研究表明, 生物材料對重金屬離子的吸附分為2個階段:第一個階段是一種快速的表面吸附, 通常在幾十分鐘內即達到最終吸附量的70%左右;第二個階段為緩慢吸附階段, 是重金屬離子向細胞內的轉移, 受胞內代謝、細胞擴散過程的控制(Soleymani et al., 2015), 這一階段常常需要數小時甚至更長的時間才能達到飽和吸附量.圖 1結果表明, P. aeruginosa對Cu2+和Pb2+均有較好的吸附效果, 吸附率隨處理時間的變化有相似趨勢.菌體與重金屬接觸的前2 h, 吸附率隨時間的增加而上升, 2 h時已完成大部分重金屬的吸附.在隨后的10 h(第2~12 h), P. aeruginosa對2種重金屬的吸附效果變化不大.從圖 1還可以看出, P. aeruginosa對1 mg·L-1Pb2+的吸附效果要優于其對相同濃度Cu2+的吸附, 2 h時二者的吸附率相差約26%.同一菌株對不同重金屬的吸附有較大差異, 竇敏娜等(2007)對菌HQ-1吸附Cd與Ag進行了比較研究, 結果表明, 該菌株對Ag的吸附能力要優于Cd, 且對Cd的吸附行為符合Langmuir模型, 對Ag的吸附行為符合Freundlich模型.

圖 1 處理時間對P. aeruginosa吸附Cu2+、Pb2+的影響
從圖 1還可以看出, 共存重金屬條件下, P. aeruginosa對目標重金屬吸附效果隨時間變化的趨勢與單一污染物的相似.分別對單一和復合吸附Cu2+、Pb2+進行差異性分析, 結果表明, 共存重金屬對目標重金屬的吸附效果影響不顯著(p>0.05).因此, 隨著吸附時間的變化, 菌株對Cu2+、Pb2+的吸附能力在1 mg·L-1重金屬共存時是基本不變的.
3.2 投菌量對P. aeruginosa吸附Cu2+和Pb2+的影響
投菌量是影響重金屬生物吸附的重要因素之一.圖 2顯示, P. aeruginosa對2種重金屬的吸附率隨著投菌量的增加呈現先迅速增加, 然后趨于平穩的趨勢, 即吸附量不再隨著投菌量的增大有顯著增大.這一現象可能與兩方面的原因有關:① 投菌量過高時, 菌體向細胞外分泌的物質會改變吸附體系的pH值, 從而改變菌體表面的物化性質或影響金屬離子在水中的存在形態, 并進一步削弱菌體對金屬離子的吸附效果;菌體向細胞外分泌的陽離子也可能會與目標吸附質發生吸附競爭;② 微生物對過量的重金屬具有生物解毒的能力, 當部分重金屬被積累到體內后, 菌體會產生多種適應機制, 如把積累進體內的重金屬運輸出體外;或者改變細胞膜的物質運輸通道, 使細胞外的重金屬更難運輸進體內;而且這些機制需要在合適的吸附質與吸附劑比例下才能成功激活和運行(Zhou et al., 2014;Ye et al., 2010).然而, 2種重金屬吸附效果達到穩定時的投菌量不同, 對于1 mg·L-1Cu2+, 投菌量為1 g·L-1時吸附效果較為理想, 而吸附1 mg·L-1Pb2+達到平穩時的投菌量為0.5 g·L-1.不少研究有類似結果, 陳永華等(2015)從鉛鋅礦渣盆栽根際土樣中分離篩選出3株耐鉛鋅菌株, 利用其對Pb2+和Zn2+進行吸附實驗, 結果表明, 蠟樣芽孢桿菌對于50 mg·L-1Pb2+吸附的最佳投菌量為0.02 g(以干重計), 而對于同樣濃度Zn2+吸附的最佳投菌量為0.06 g, 解硫胺素芽孢桿菌和藤黃微球菌對于2種重金屬吸附的最佳投菌量同樣有較大差異.
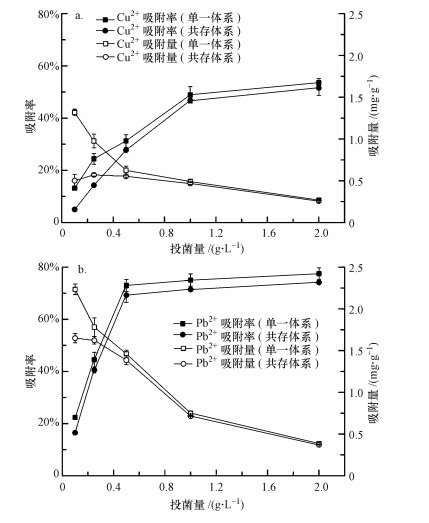
圖 2 投菌量對P. aeruginosa吸附Cu2+(a)和Pb2+(b)的影響
圖 2結果表明, 當體系中只含有單一重金屬時, 單位質量菌體對Cu2+、Pb2+的吸附量隨投菌量的增加呈下降趨勢.其主要原因是隨著投菌量的增加, 吸附質與吸附劑的比例減小, 從而導致單位質量菌體可以吸附的重金屬量減少.從圖 2還可以看出, 共存重金屬對菌體吸附目標離子有影響.對于吸附率, 其變化趨勢與單一重金屬體系隨投菌量的變化趨勢相似, 僅吸附效果略有降低;對于單位吸附量, 投菌量較低時(≤0.25 g·L-1), Pb2+對菌體吸附Cu2+的影響要大于Cu2+對菌體吸附Pb2+的影響.當投菌量為0.1 g·L-1時, Pb2+共存下, 單位質量菌體吸附1 mg·L-1 Cu2+的量下降約61.9%, 而Cu2+共存下, Pb2+單位吸附量下降26.2%.這一結果表明, P. aeruginosa對Pb的吸附能力強于Cu, 當吸附劑的數量不足時, 菌株優先以Pb為吸附目標.方差分析結果表明, 投菌量對2種重金屬的吸附影響極顯著(p < 0.01).共存重金屬離子對菌株吸附率無顯著性影響(p>0.05), 但對單位質量菌體的吸附量有較顯著的影響(p < 0.05).
3.3 pH對P. aeruginosa吸附Cu2+和Pb2+的影響
初始pH對P. aeruginosa吸附重金屬的影響見圖 3.pH為3時, 菌體對Cu2+和Pb2+的吸附效果較差, 吸附率僅分別為7.4%和10.3%, 而當pH為5~8時, 2種重金屬的吸附效果較理想且變化較平穩.這是由于在含有重金屬的吸附液中, 首先與重金屬接觸的是細菌細胞壁, 在細胞壁上有許多帶負電荷的官能團, 其中, 羧基和氨基是活性位點, 當pH過低時, 菌體表面的質子化會抑制重金屬離子的吸附, 即H3O+會占據大量的吸附活性位點, 阻止陽離子與吸附活性位點的接觸, 因此, 質子化程度越高, 吸附劑對重金屬離子的斥力越大, 從而導致吸附量下降;而且, 過酸的環境對菌體正常生理功能會產生影響, 削弱菌體對銅的生物積累能力.隨著pH值升高, 細胞表面官能團開始脫質子化, 官能團的負電荷逐漸暴露出來, 因此, 鎘與活性位點結合量增加(Vale et al., 2016);當pH值過高, 達到重金屬離子的Ksp值后, 很多金屬離子會生成氫氧化物沉淀, 無法體現生物吸附作用對金屬的去除效果(賈成光等, 2014).方差分析結果表明, pH對菌體吸附2種重金屬均有有較為顯著的影響(p < 0.05).但隨著pH值的變化, P. aeruginosa對Cu2+和Pb2+的吸附能力在兩者共存時的變化不顯著(p>0.05).

圖 3 pH對P. aeruginosa吸附Cu2+、Pb2+的影響
3.4 不同濃度重金屬共存下P. aeruginosa吸附性能
通過改變共存重金屬的濃度考察P. aeruginosa對目標重金屬的吸附效果變化規律, 結果如圖 4所示.從圖 4a可以看出, Pb2+的加入對菌體吸附Cu2+有抑制作用, 且抑制效果隨著Pb2+濃度的增加而增大, 主要原因是Pb2+的加入占據了菌體吸附位點, 從而影響其對目標離子的吸附.圖 4b表明, Cu2+的加入對菌體吸附Pb2+的影響無明顯規律, 僅當Cu2+濃度為5和10 mg·L-1時其吸附率有較顯著的變化(p < 0.05).造成上述結果的可能原因是P. aeruginosa對于2種重金屬的吸附機理不同.菌體對Pb2+的吸附不但與其表面性質有關, 可能還與菌體理化性質等有關, Cu2+的加入雖然占據了吸附位點, 但同樣會改變菌體分泌物與細胞結構, 從而影響其對目標離子的吸附.周維芝等(2009)研究了深海適冷菌胞外多糖(EPS)對Pb2+和Cu2+的吸附性能, 結果表明, EPS對Pb2+和Cu2+的吸附量隨EPS投加量的增加而減小.為了驗證這一猜測, 考察了Pb2+和Cu2+對P. aeruginosa EPS產量的影響, EPS的提取與檢測方法參照文獻(Wang et al., 2012).實驗結果(具體數據未列出)表明, 較高濃度(10 mg·L-1)的Pb2+和Cu2+均會抑制菌體EPS的分泌(Cu和Pb對EPS的抑制率分別為43.7%、11.4%).
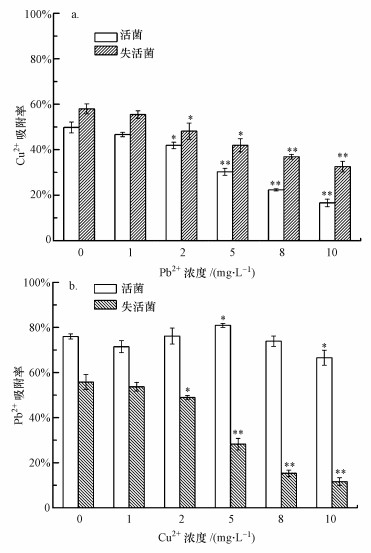
圖 4 共存重金屬對P. aeruginosa吸附Cu2+(a)和Pb2+(b)的影響 (*表示與對照相比p < 0.05, **表示與對照相比p < 0.01)
為進一步說明上述結論, 研究了不同濃度重金屬共存下失活菌體的吸附性能.本實驗利用戊二醛作為失活劑固定菌體, 可以將細胞活性狀態時的結構和菌體表面的功能基團完整地保留, 并終止菌體正常的生理生化功能, 從而考察菌體表面吸附與內部擴散作用對重金屬生物吸附貢獻大小.從圖 4a可以看出, 當體系中無Pb2+存在時, 失活菌對Cu2+吸附率較活菌有較顯著的提高(p < 0.05), 這一結果與白潔瓊等(2013)的研究結果一致, 說明P. aeruginosa對Cu2+的吸附作用不僅包括菌體表面吸附, 還包括跨膜的主動運輸、菌體表面脫附和菌體對金屬的主動釋放等作用.失活后的菌體對Cu2+的吸附僅為表面吸附, 不存在主動釋放與運輸Cu2+的過程, 因此, 吸附率較活菌有提高.圖 4b表明, 當體系中無Cu2+存在時, 失活菌對Pb2+吸附率較活菌有顯著的降低(p < 0.01).原因是Pb2+的生物吸附存在表面吸附和胞內積累行為, 失活后, 菌體不具備對Pb2+進行胞內積累的能力, 從而導致了吸附率的下降.Zhu等(2016)研究了失活前后Mucoromycotesp. XLC對Cd2+和Ni2+吸附能力的差異, 結果表明, 造成活菌與失活菌吸附差異的主要原因是其胞內金屬離子的含量變化.
綜合圖 4可知, 對于活菌, 外源重金屬的濃度對P. aeruginosa吸附Pb2+和Cu2+的影響有較大差異;而對于失活菌, P. aeruginosa吸附Pb2+和Cu2+的效果均隨外源重金屬濃度的增大而降低, 且Cu2+對Pb2+的影響要比Pb2+對Cu2+的影響更為顯著.這一現象同樣說明P. aeruginosa對于2種重金屬的吸附機理不同, 菌體對Pb2+的吸附作用與菌體活性密切相關.研究表明, 生物吸附機理可分為代謝依賴型和非代謝依賴型(Wang et al., 2009), P. aeruginosa對于Pb2+的吸附屬于前者, 而對于Cu2+的吸附屬于后者.
3.5 P. aeruginosa吸附重金屬前后形態變化
圖 5為P. aeruginosa吸附重金屬離子前后的SEM圖.總體上看, 吸附前后大部分菌體均能保持正常形態, 未出現細胞干癟或破裂的情況.通過比較可以發現, 吸附后的菌體聚集性更好, 而吸附前的細胞較為分散.原因可能是重金屬離子的存在使細胞分泌物增加, 從而增強了細胞之間的凝聚性和粘附性.相關研究指出(Yin et al., 2008), 重金屬能與菌體分泌到細胞外的生物大分子發生螯合后形成復合物.由于這些生物大分子的主要成分是多糖和蛋白質, 具有很好的粘性, 可以促進重金屬吸附于菌體細胞表面, 是金屬離子與微生物吸附劑間的橋梁.此外, 這些分泌物與重金屬發生螯合后, 可以有效降低重金屬的毒性, 從而使吸附后的菌體仍保持飽滿的細胞結構.

圖 5 菌體掃描電鏡圖 (a.吸附前, b.吸附Cu2+和Pb2+后)
4 結論(Conclusions)
1)P. aeruginosa對Cu2+和Pb2+的吸附效果隨處理時間呈先上升后平穩的變化趨勢, 2 h后吸附效果達到穩定.吸附率隨投菌量的增加先迅速增加, 后趨于平穩.對于Cu2+, 投菌量為1 g·L-1時吸附效果達到穩定, 而Pb2+吸附率達到平穩時的投菌量為0.5 g·L-1.單位質量菌體對Cu2+、Pb2+的吸附量隨投菌量的增加呈下降趨勢.pH為3時, 菌體對Cu2+和Pb2+的吸附效果較差, 而當pH為5~8時, 2種重金屬的吸附效果較理想.隨著處理時間、投菌量、pH值的變化, 共存重金屬離子對菌株吸附率均無顯著性影響, 僅對單位質量菌體的吸附量有較顯著的影響.具體參見污水寶商城資料或http://www.jianfeilema.cn更多相關技術文檔。
2) 對于活菌, Pb2+的加入對菌體吸附Cu2+有抑制作用, 且抑制效果隨著Pb2+濃度的增加而增大;而Cu2+的加入對菌體吸附Pb2+的影響無明顯規律.對于失活菌, P. aeruginosa吸附Pb2+和Cu2+的效果均隨外源重金屬濃度的增大而降低, Cu2+對Pb2+的影響要比Pb2+對Cu2+的影響更為顯著.
3) SEM實驗觀察發現, 菌體吸附前后均能保持正常形態, 未出現細胞干癟或破裂的情況, 吸附后的菌體較吸附前聚集性更好.


