地表水體富營養(yǎng)化是當今世界許多國家最為關注的水環(huán)境問題之一,而工業(yè)、農(nóng)業(yè)和家庭等磷源向地表水體的過量排放可以導致水體發(fā)生嚴重的富營養(yǎng)化.因此,含磷廢水排入地表水體之前,對它們所含的磷進行去除是非常必要的.目前,許多方法已經(jīng)被開發(fā)用于水中磷的去除,包括生物法、化學沉淀法、結晶法、離子交換法和吸附法.其中,吸附法被認為是一種極具應用潛力的水中磷酸鹽去除方法.目前,許多吸附劑材料,特別是金屬 (鋁、鐵、鑭、鈰和鋯等) 氧化物和氫氧化物已經(jīng)被開發(fā)用于水中磷酸鹽的吸附去除.其中,水合氧化鋯被認為是一種極具應用前景的除磷吸附劑材料,因為利用水合氧化鋯作為除磷吸附劑材料具備許多顯著的優(yōu)點:對磷的吸附能力強、無毒、對氧化劑的抗氧化能力強、酸性和堿性條件下物理化學性質穩(wěn)定等.
水合氧化鋯可以通過液相沉淀法制備得到,具體制備過程可以是:首先選用可溶性鋯鹽配制鋯鹽溶液,再向鋯鹽溶液投加沉淀劑調節(jié)溶液的pH值,通過化學反應使鋯離子沉淀或結晶出來,最后將沉淀物從溶液中分離出來.當向鋯鹽溶液中投加不同劑量的沉淀劑時,鋯鹽溶液的最終pH值預計是不同的,并且所形成的水合氧化鋯表面性質可能是不同的,而不同表面性質的水合氧化鋯對水中磷酸鹽的吸附能力可能是不同的.因此,對比分析不同沉淀pH值條件下制備得到的水合氧化鋯對水中磷酸鹽的吸附作用,對于應用水合氧化鋯吸附去除水中磷酸鹽而言是非常必要的.目前,國內外關于這方面的研究尚鮮見報道.因此,本文的研究目標就是對比不同分析不同沉淀pH值條件下制備的水合氧化鋯對水中磷酸鹽的吸附作用.為實現(xiàn)這個目標,本文首先考察了溶液共存電解質和溶液pH值對不同沉淀pH值條件下制備的水合氧化鋯吸附水中磷酸鹽的影響,并對比分析了共存不同類型電解質條件下不同水合氧化鋯對水中磷酸鹽的吸附性能,再對比考察了不存在Ca2+和存在Ca2+這2種情況下不同水合氧化鋯對水中磷酸鹽的吸附等溫線,最后對比分析了不同水合氧化鋯的吸磷機制,以期為應用水合氧化鋯去除水中磷酸鹽提供幫助.
1 材料與方法1.1 水合氧化鋯制備
分別稱取3份質量均為20 g的八水氧氯化鋯 (ZrOCl2 ·8H2O) 置于3個1 L錐形瓶中,再分別向每個錐形瓶加入400 mL水,使錐形瓶中ZrOCl2 ·8H2O溶解;利用移液管分別將不同劑量的1 mol ·L-1 NaOH溶液緩慢滴加到上述3份ZrOCl2溶液中,滴加過程中采用磁力攪拌器對錐形瓶中溶液進行攪拌,最終使上述錐形瓶中溶液的pH值分別為4.8、8.0和10.6;反應完成后將上述錐形瓶中混合液采用離心分離的方式獲得固體材料,再用去離子水反復洗滌所獲得的固體材料,直至清洗液中無氯離子檢出 (采用AgNO3溶液檢測);最后將沉淀物放入105℃烘箱內烘干,研磨破碎,放入樣本瓶中待用.沉淀pH值為4.8、8.0和10.6條件下制備得到的水合氧化鋯分別命名為ZrO2(4.8)、ZrO2(8.0) 和ZrO2(10.6).
1.2 水合氧化鋯表征
采用X射線熒光光譜 (XRF) 儀 (日本島津公司生產(chǎn),型號為XRF-1800) 對不同沉淀pH值條件下制備的水合氧化鋯的化學成分進行測定.采用pH值漂移法對不同沉淀pH值條件下制備的水合氧化鋯表面的質子化和去質子化反應進行研究,具體的實驗過程為:配制0.01 mol ·L-1 NaNO3溶液,并將它們的pH值分別調節(jié)至4、5、6、7、9、10和11;分別稱取20 mg水合氧化鋯加入到一系列的塑料瓶中,再分別加入不同初始pH值 (pHi) 的NaNO3溶液;然后再將塑料瓶置于25℃的水浴振蕩器中進行振蕩反應;反應72 h后測定NaNO3溶液的最終pH值 (pHf);以pHi為橫坐標,以ΔpH=pHi-pHf為縱坐標作出曲線,pHi-pHf=0時的pHi即為水合氧化鋯的零電荷點 (pHPZC).
1.3 吸附實驗
通過批量吸附實驗首先考察溶液共存電解質 (NaCl、NaHCO3、Na2SO4和CaCl2等) 對不同水合氧化鋯吸附水中磷酸鹽的影響,再考察溶液pH值對不同水合氧化鋯吸附水中磷酸鹽的影響,最后對比考察不存在Ca2+和存在Ca2+條件下不同水合氧化鋯對水中磷酸鹽的吸附等溫線.具體的實驗步驟為:首先采用KH2PO4配制磷酸鹽溶液 (質量濃度均以PO43-計),再采用0.1 mol ·L-1 NaOH和HCl溶液將磷酸鹽溶液的pH值調節(jié)至一定的值;然后量取25 mL的磷酸鹽和稱取10 mg水合氧化鋯一并置于錐形瓶中,再將錐形瓶置于25℃的水浴振蕩器中以150 r ·min-1的速度進行振蕩反應;反應24 h后,取出錐形瓶,采用離心分離方式對錐形瓶中的混合液進行固液分離,再采用鉬銻抗分光光度法測定上清液中磷酸鹽的濃度,并采用便攜式pH計測定上清液中的最終pH值.對于共存電解質影響實驗,溶液初始pH值為7,磷酸鹽初始質量濃度為40 mg ·L-1,共存電解質初始濃度為2 mmol ·L-1.對于溶液pH值影響實驗,溶液初始pH值分別為4、5、6、7、8、9、10和11,磷酸鹽初始質量濃度為40 mg ·L-1,共存NaCl初始濃度為10 mmol ·L-1.對于吸附等溫線實驗,溶液初始pH值為7,溶液共存NaCl濃度為10 mmol ·L-1,共存Ca2+濃度為0或1 mmol ·L-1.
為識別共存Ca2+對水合氧化鋯吸附水中磷酸鹽的影響機制,對比考察了水合氧化鋯和Ca2+負載水合氧化鋯對水中磷酸鹽的吸附能力.具體的實驗步驟為:首先將50 mg水合氧化鋯與125 mL的1 mmol ·L-1 CaCl2溶液混合,反應24 h后制備得到Ca2+負載水合氧化鋯;然后再分別將10 mg水合氧化鋯和10 mg Ca2+負載水合氧化鋯與25 mL的30 mg ·L-1磷酸鹽溶液 (共存NaCl濃度為10 mmol ·L-1,pH 7) 混合,反應24 h后離心分離;最后測定上清液中磷酸鹽的濃度.
為進一步識別Ca2+對水合氧化鋯吸附水中磷酸鹽的影響機制,還對比考察了磷負載水合氧化鋯和先磷負載再Ca2+負載水合氧化鋯對水中磷酸鹽的吸附能力.具體實驗步驟為:首先將100 mg水合氧化鋯與250 mL的30 mg ·L-1磷酸鹽溶液 (pH為7) 混合,反應24 h后制備得到磷負載水合氧化鋯;然后再將50 mg磷負載水合氧化鋯與125 mL的1 mmol ·L-1CaCl2溶液混合,制備得到先磷負載再Ca2+負載水合氧化鋯;然后再分別將10 mg磷負載水合氧化鋯和10 mg先磷負載再Ca2+負載水合氧化鋯與25 mL的30 mg ·L-1磷酸鹽溶液 (共存NaCl濃度為10 mmol ·L-1,pH 7) 混合,反應24 h后離心分離;最后測定上清液中磷酸鹽的濃度.
1.4 數(shù)據(jù)處理
水合氧化鋯對水中磷酸鹽的單位吸附量 (Qe,mg ·g-1) 采用公式 (1) 進行計算:

式中,c0和ce分別為初始時刻和平衡時刻溶液中磷酸鹽的質量濃度 (mg ·L-1);V為溶液體積 (L);m為水合氧化鋯投加質量 (g).
為了研究吸附機制以及確定最大吸附容量等信息,采用Langmuir、Freundlich和Dubinin-Redushckevich (D-R) 等溫吸附模型對等溫吸附線實驗數(shù)據(jù)進行擬合.線性化Langmuir等溫吸附模型的數(shù)學表達式為:

式中,ce為水中吸附質的平衡質量濃度 (mg ·L-1);Qe為吸附劑對水中吸附質的單位吸附量 (mg ·g-1);Qm為吸附劑對吸附質的最大單層單位吸附量 (mg ·g-1);KL為Langmuir常數(shù) (L ·mg-1).無量綱常數(shù)分離因子 (RL) 可以用于表達Langmuir等溫吸附線的本質特征,它可以采用以下公式進行計算:

式中,c0為水中吸附質的初始質量濃度 (mg ·L-1). RL值可以指示吸附的優(yōu)惠性:① 0 < RL < 1,優(yōu)惠吸附;② RL>1,非優(yōu)惠吸附;③ RL=1,線性吸附;④ RL=0,不可逆吸附.線性化Freundlich等溫吸附模型的數(shù)學表達式為:
式中,KF和1/n為Freundlich常數(shù). KF與吸附劑的吸附容量直接相關,KF值越大,表示吸附容量越大.如果n>1,則吸附屬于優(yōu)惠吸附.線性化D-R吸附等溫模型的數(shù)學表達式為:
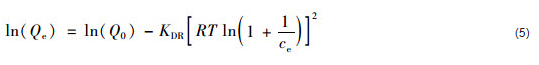
式中,ce為水中吸附質的平衡濃度 (mol ·L-1);Qe為吸附劑對水中吸附質的單位吸附量 (mg ·g-1);Q0為吸附劑對水中吸附質的最大單位吸附量 (mg ·g-1);KDR為D-R等溫吸附模型常數(shù) (mol2 ·kJ-2);T為反應溫度 (K);R為理想氣體常數(shù)[kJ ·(mol ·K)-1]. KDR可以被用來進一步計算平均吸附自由能 (E,kJ ·mol-1). E的計算公式為:

如果吸附反應屬于物理吸附,那么E值通常是小于8 kJ ·mol-1[30].如果吸附反應屬于化學吸附,那么E值通常是大于8 kJ ·mol-1.
2 結果與討論2.1 水合氧化鋯性質表征
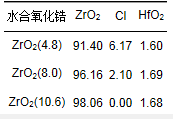
沉淀pH值分別為4.8、8.0和10.6條件下制備的水合氧化鋯的化學成分組成 (質量分數(shù)) 見表 1.由表 1可見,不同沉淀pH值條件下制備的水合氧化鋯的化學成分均主要為ZrO2.這說明通過液相沉淀法可以成功地制備得到氧化鋯.由表 1還可見,ZrO2(4.8) 和ZrO2(8.0) 還包含少量的Cl,并且ZrO2(8.0) 的Cl含量明顯低于ZrO2(4.8),而ZrO2(10.6) 則不含Cl.這說明,隨著沉淀pH值的增加,水合氧化鋯的Cl含量出現(xiàn)下降,直至最終消失.
表 1 不同沉淀pH值條件下制備的水合氧化鋯的化學成分/%
不同沉淀pH值條件下制備的水合氧化鋯的pHi-pHf與pHi的關系見圖 1.從中可見,當溶液pH值為4~11時,ZrO2(4.8) 和ZrO2(8.0) 均會通過表面羥基的去質子化反應[見方程式 (7)]消耗溶液中OH-,從而導致溶液pH值的下降.這2種水合氧化鋯的pHPZC顯然均是低于4.與ZrO2(8.0) 相比,ZrO2(4.8) 消耗溶液中OH-的能力更強,從而導致溶液pH值的下降幅度更大.由圖 1還可見,ZrO2(10.6) 的pHPZC為6.6;當溶液pH值小于6.6時,ZrO2(10.6) 會通過表面羥基的質子化反應[見方程式 (8)]消耗溶液中H+,從而導致溶液pH值的增加;當溶液pH值大于6.6時,ZrO2(10.6) 則會通過表面羥基的去質子化反應[見方程式 (7)]消耗溶液中OH-,從而導致溶液pH值的下降.當溶液pH值大于6.6時,與ZrO2(10.6) 相比,ZrO2(8.0) 消耗溶液中OH-的能力更強,從而導致溶液pH值的下降幅度更大.
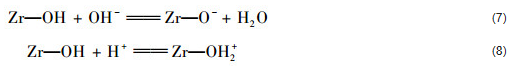

圖 1 不同沉淀pH值條件下所得水合氧化鋯的pHi-pHf與pHi的關系
根據(jù)以上分析可知,當溶液pH值為4~11時,ZrO2(4.8) 和ZrO2(8.0) 表面電荷均為負值;當溶液pH值為4~6.6時,ZrO2(10.6) 表面電荷為正值,而當溶液pH值為6.6~11時,ZrO2(10.6) 表面電荷則為負值.當溶液pH值大于水合氧化鋯的pHPZC時,隨著制備水合氧化鋯的沉淀pH值的增加,水合氧化鋯表面攜帶的負電荷數(shù)量預計更少.
2.2 共存電解質對磷吸附的影響以及不同水合氧化鋯吸磷性能的對比
城市污水中通常會存在Cl-、HCO3-、SO42-、Na+和Ca2+等陰陽離子,它們可能會影響水合氧化鋯對城市污水中磷酸鹽的吸附去除.因此,為了確定利用水合氧化鋯吸附去除城市污水中磷酸鹽的可行性,探討共存NaCl、CaCl2、NaHCO3和Na2SO4等電解質對水合氧化鋯吸附水中磷酸鹽的影響是非常必要的. 圖 2為共存電解質對不同沉淀pH值條件下制備的水合氧化鋯吸附水中磷酸鹽的影響.從中可見,當溶液共存的NaCl濃度由0增加到2 mmol ·L-1時,ZrO2(4.8)、ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的單位吸附量分別增加了8.1%、2.3%和33.3%.這說明共存的NaCl僅僅會略微促進了ZrO2(4.8) 和ZrO2(8.0) 對水中磷酸鹽的吸附,卻會極大地促進了ZrO2(10.6) 對水中磷酸鹽的吸附.水合金屬氧化物包括水合氧化鋯吸附水中磷酸鹽的機制包括2種:① 靜電吸引作用和外層配合物形成;② 配位體交換作用和內層配合物形成.當磷酸鹽溶液初始pH值為7時,ZrO2(4.8)、ZrO2(8.0) 和ZrO2(10.6) 表面帶負電荷.因此,當溶液初始pH值為7時,靜電吸引不是這3種水合氧化鋯吸附水中磷酸鹽的主要機制.吸附對離子強度的依賴程度可以被認為是識別內層配合物和外層配合物形成的依據(jù).如果磷酸鹽被吸附到吸附劑表面上后形成了外層配合物,則離子強度會抑制吸附劑對磷酸鹽的吸附.如果磷酸鹽被吸附到吸附劑表面上后形成了內層配合物,則離子強度對磷酸鹽吸附無影響或者促進了磷酸鹽吸附[15]. 圖 2的實驗結果說明了當溶液初始pH值為7時磷酸鹽主要以內層配合物形式被吸附到ZrO2(4.8)、ZrO2(8.0) 和ZrO2(10.6) 表面上.考慮到Cl-對水合氧化鋯吸附水中磷酸鹽幾乎無負面影響,因此圖 2的實驗結果說明了共存的Na+促進了水合氧化鋯對水中磷酸鹽的吸附.

圖 2 共存電解質對不同沉淀pH值條件下所得水合氧化鋯吸附水中磷酸鹽的影響
與不存在電解質相比,存在2 mmol ·L-1 CaCl2情況下ZrO2(4.8)、ZrO2(8.0) 和ZrO2(10.6) 鋯對水中磷酸鹽的單位吸附量分別增加了5.2%、66.8%和144%(圖 2).考慮到Cl-對水合氧化鋯吸附水中磷酸鹽幾乎無負面影響,因此圖 2的實驗結果說明了共存的Ca2+僅僅會略微促進了ZrO2(4.8) 對水中磷酸鹽的吸附,卻會極大地促進了ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的吸附.此外,進一步對比分析Na+和Ca2+對水合氧化鋯吸附水中磷酸鹽的促進作用發(fā)現(xiàn),Na+和Ca2+對ZrO2(4.8) 吸附水中磷酸鹽的促進作用差別不大,而對ZrO2(8.0) 和ZrO2(10.6) 吸附水中磷酸鹽的促進作用卻差別巨大.共存Ca2+對ZrO2(8.0) 和ZrO2(10.6) 吸附水中磷酸鹽的促進作用遠遠大于共存的Na+.
與存在2 mmol ·L-1 NaCl相比,存在2 mmol ·L-1 Na2SO4情況下ZrO2(4.8)、ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的單位吸附量分別下降了26.9%、2.7%和7.7%(圖 2).這說明共存SO42-極大地抑制了ZrO2(4.8) 對水中磷酸鹽的吸附,而僅僅是略微抑制了ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的吸附.與存在2 mmol ·L-1 NaCl相比,存在2 mmol ·L-1 NaHCO3情況下ZrO2(4.8)、ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的單位吸附量分別下降了68.5%、18.6%和13.9%(圖 2).這說明共促的HCO3-會抑制水合氧化鋯對水中磷酸鹽的吸附,并且對ZrO2(4.8) 吸附磷酸鹽的抑制作用遠大于對ZrO2(8.0) 和ZrO2(10.6). HCO3-和SO42-抑制水合氧化鋯對水中磷酸鹽的吸附,這主要是因為HCO3-和SO42-會與磷酸根陰離子競爭水合氧化鋯表面的活性吸附位即表面羥基基團 (Zr-OH) 的緣故.與存在Na2SO4情況下相比,存在NaHCO3情況下水合氧化鋯對水中磷酸鹽的單位吸附量較低 (圖 2).這說明共存的HCO3-對水合氧化鋯吸附水中磷酸鹽的抑制作用強于SO42-.這可能是因為HCO3-與吸附活性位的結合能力大于SO42-的緣故.
不同水合氧化鋯對水中磷酸鹽吸附能力的差異,與是否共存電解質以及共存電解質種類密切相關.當不存在共存電解質時,ZrO2(4.8) 對磷酸鹽吸附能力略強于ZrO2(8.0),后者的磷酸鹽單位吸附量僅比前者少了7.4%.同樣情況下,ZrO2(4.8) 對磷酸鹽的吸附能力卻明顯高于ZrO2(10.6),后者的磷酸鹽單位吸附量足足比前者少了24.8%.這說明隨著制備水合氧化鋯的沉淀pH值增加,水合氧化鋯對純磷酸鹽溶液中磷吸附能力逐漸下降.水合氧化鋯對水中磷酸鹽的吸附能力可能不僅受吸附劑表面性質的影響,而且受水中磷酸鹽存在形態(tài)的影響.一方面,隨著制備水合氧化鋯時沉淀pH值增加,水合氧化鋯表面負電荷數(shù)量逐漸減少,從而使得水中帶負電荷的磷酸鹽和吸附劑表面之間的靜電排斥力減少,這有利于水中磷酸鹽的被吸附.另一方面,沉淀pH值越高條件下制備的水合氧化鋯導致溶液pH值下降的幅度越小,從而使得溶液中以HPO42-形態(tài)存在的磷酸鹽越多而以H2PO4-形態(tài)存在的磷酸鹽越少,這將不利于水中磷酸鹽的被吸附,因為H2PO4-的吸附自由能更小,更有利于被水合氧化鋯通過配位體交換作用所吸附.吸附劑表面負電荷數(shù)量變化所帶來的有利影響會被水中磷酸鹽形態(tài)變化所帶來的不利影響所抵消,從而導致沉淀pH值越高時所得水合氧化鋯對純磷酸鹽中磷吸附能力越低.
共存2 mmol ·L-1 NaCl情況下,ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽單位吸附量僅比ZrO2(4.8) 略低,前二者的磷酸鹽單位吸附量比后者分別低12.4%和8.4%.因此,如果城市污水僅僅共存Na+和Cl-情況下,沉淀pH值為4.8、8.0和10.6這3種情況下制備的水合氧化鋯均適合用于城市污水中磷酸鹽的去除.
共存2 mmol ·L-1 CaCl2情況下,ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的吸附能力明顯強于ZrO2(4.8),前二者的磷酸鹽單位吸附量分別比后者足足多了46.8%和74.3%.因此,如果城市污水存在Ca2+的情況下,與沉淀pH值為4.8時所得水合氧化鋯相比,沉淀pH值為8.0和10.6時所得水合氧化鋯更適合作為吸附劑用于城市污水中磷酸鹽的去除.
共存2 mmol ·L-1 NaHCO3情況下,ZrO2(10.6) 對水中磷酸鹽的吸附能力略強于ZrO2(8.0),后者的磷酸鹽單位吸附量比前者僅少了10.6%.同樣情況下,ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的吸附能力明顯高于ZrO2(4.8),后者的磷酸鹽單位吸附量分別比前二者足足少了55.8%和60.5%.因此,如果城市污水存在HCO3-離子情況下,與沉淀pH值為4.8時所得水合氧化鋯相比,沉淀pH值為8.0和10.6時所得水合氧化鋯更適合作為吸附劑用于城市污水中磷酸鹽的去除.
共存2 mmol ·L-1 Na2SO4情況下,ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的吸附能力沒有區(qū)別,而這2種水合氧化鋯的吸磷能力均高于ZrO2(4.8).因此,如果污水存在SO42-條件下,沉淀pH值8.0和10.6所得水合氧化鋯比沉淀pH值4.8所得水合氧化鋯更適合作為吸附劑用于城市污水中磷酸鹽的去除.
2.3 溶液pH值對磷吸附的影響
溶液pH值不僅會影響水合氧化鋯表面的電荷、功能基團等性質,而且還會影響水中磷酸鹽的存在形式,最終可能影響到水合氧化鋯對水中磷酸鹽的吸附能力.因此,探討溶液pH值對不同沉淀pH條件下所得水合氧化鋯吸磷能力的影響,對于應用水合氧化鋯去除水中磷酸鹽而言是非常必要的.共存NaCl情況下,溶液初始pH值對不同沉淀pH值條件下所得水合氧化鋯吸附水中磷酸鹽的影響見圖 3(a).從中可見,不同沉淀pH值條件下所得水合氧化鋯對水中磷酸鹽的吸附能力均隨溶液pH值的增加而降低.這說明酸性條件下有利于水合氧化鋯對水中磷酸鹽的吸附,而堿性條件不利于水合氧化鋯對水中磷酸鹽的吸附.這可以從以下幾個方面得到解釋.首先,隨著溶液pH值的增加,水中以H2PO4-形式存在的磷酸鹽量逐漸減少,而以HPO42-形式存在的磷酸鹽量逐漸增加,H2PO4-的吸附自由能更小,更有利于通過配位體交換作用被水合金屬氧化物所吸附,從而導致水合氧化鋯對水中磷酸鹽的吸附能力隨溶液pH值的增加而降低.其次,當溶液pH值小于pHPZC時,隨著溶液pH值的增加,水合氧化鋯表面的Zr—OH2+基團會通過去質子化反應逐漸被轉換為Zr—OH基團,而Zr—OH2+對磷酸鹽的吸附而言具備更高的活性,從而不利于水合氧化鋯對水中磷酸鹽的吸附.再次,當溶液pH值大于pHPZC時,隨著溶液pH值的增加,水合金屬氧化物表面的負電荷數(shù)量逐漸增加,從而使得帶負電荷的水合金屬氧化物表面和水中帶負電荷的磷酸根陰離子之間的靜電排斥力逐漸增加,從而不利于水合氧化鋯對水中磷酸鹽的吸附.最后,較高pH值條件下,水中存在的OH-和磷酸鹽對水合金屬氧化物的競爭吸附作用降低了磷吸附能力.

圖 3 溶液初始pH值對不同沉淀pH值條件下所得水合氧化鋯吸附水中磷酸鹽和溶液最終pH值的影響
為了調查水合氧化鋯吸附水中磷酸鹽的機制,測定了吸附反應后不同初始pH值條件下磷酸鹽溶液的最終pH值,并計算得到磷酸鹽溶液的初始pH值 (pHi) 與最終pH值 (pHf) 之間的差值,結果見圖 3(b).從中可見,當初始pH值為4時,ZrO2(4.8) 會導致磷酸鹽溶液最終pH值的增加,而當初始pH值為5~11,磷酸鹽溶液最終pH值則出現(xiàn)下降.當初始pH值為4~6時,ZrO2(8.0) 會導致磷酸鹽溶液最終pH值的增加,而當初始pH值7~11時,磷酸鹽溶液的最終pH值則出現(xiàn)下降.當初始pH值為4~7時,ZrO2(10.6) 會導致磷酸鹽溶液最終pH值的增加,而當初始pH值8~11時,磷酸鹽溶液的最終pH值則出現(xiàn)下降.對比分析圖 1和圖 3(b)的實驗數(shù)據(jù)發(fā)現(xiàn),相同的溶液初始pH值條件下,投加水合氧化鋯后,磷酸鹽溶液的最終pH值明顯大于不含磷酸鹽溶液的最終pH值.這意味著水合氧化鋯吸附磷酸鹽必定釋放出一定數(shù)量的OH-,因為如果水合氧化鋯吸附磷酸鹽后沒有釋放出OH-的話,磷酸鹽溶液的最終pH值必定不會明顯大于不含磷酸鹽溶液的最終pH值.吸附反應前后磷酸鹽溶液pH值變化證實了,水合氧化鋯表面羥基基團和水中磷酸鹽之間的配位體交換作用是水合氧化鋯吸附磷酸鹽的一個重要機制.
2.4 存在Na+而不存在Ca2+條件下不同水合氧化鋯磷吸附等溫線對比
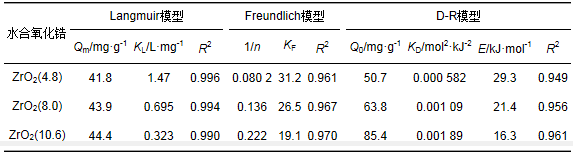
圖 4為存在Na+而不存在Ca2+條件下不同沉淀pH值時所得水合氧化鋯對水中磷酸鹽的吸附等溫線實驗結果.從中可知,水合氧化鋯對水中磷酸鹽單位吸附量隨著水中磷酸鹽平衡濃度的增加而增加,最后達到吸附飽和.采用線性化Langmuir、Freundlich和D-R等溫吸附模型對圖 4實驗數(shù)據(jù)進行線性擬合,計算得到的各等溫吸附模型的參數(shù)和相關系數(shù) (R2) 見表 2.根據(jù)各模型參數(shù)計算得到的等溫吸附線亦見圖 4.由表 2和圖 4可見,存在Na+而不存在Ca2+條件下,ZrO2(4.8)、ZrO2(8.0) 和ZrO2(10.6) 鋯對水中磷酸鹽的吸附等溫實驗數(shù)據(jù)均可以采用Langmuir、Freundlich和D-R等溫吸附模型加以描述.根據(jù)Langmuir等溫吸附模型計算得到ZrO2(4.8)、ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的最大單層吸附量分別為41.8、43.9和44.4 mg ·g-1.這說明存在Na+而不存在Ca2+條件下不同沉淀pH值時所制備的水合氧化鋯的飽和吸附容量差別不大.當磷酸鹽初始濃度位于10~50 mg ·L-1之間時,根據(jù)Langmuir等溫吸附模型計算得到的ZrO2(4.8)、ZrO2(8.0) 和ZrO2(10.6) 的RL值分別為0.013~0.064、0.028~0.126和0.058~0.237,均位于0~1之間,這說明吸附反應是優(yōu)惠的.根據(jù)Freundlich等溫吸附模型計算得到的ZrO2(4.8)、ZrO2(8.0) 和ZrO2(10.6) 的1/n值均位于0~1之間,這也說明吸附反應是優(yōu)惠的.根據(jù)D-R等溫吸附模型計算得到的E值均大于8 kJ ·mol-1,這說明了吸附反應屬于化學吸附.這證實了存在Na+而不存在Ca2+條件下ZrO2(4.8)、ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的吸附機制為配位體交換和內層配合物形成.這與根據(jù)離子強度對吸附影響、吸附前后溶液pH變化所得出的結論是相一致的.

圖 4 存在Na+而不存在Ca2+條件下不同沉淀pH值時所得水合氧化鋯對水中磷酸鹽的吸附等溫線
表 2 存在Na+而不存在Ca2+條件下水合氧化鋯對磷酸鹽的吸附等溫線擬合參數(shù)和相關系數(shù)
2.5 存在Ca2+條件下不同水合氧化鋯磷吸附等溫線對比分析
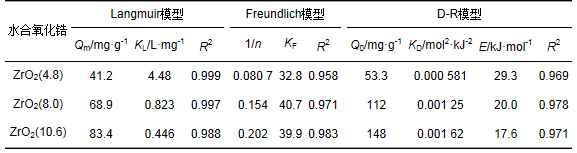
圖 5為存在Ca2+條件下不同沉淀pH值時所得水合氧化鋯對水中磷酸鹽的吸附等溫線實驗數(shù)據(jù).由圖 5可見,存在Ca2+時,相同的磷酸鹽平衡濃度條件下ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的單位吸附量明顯高于ZrO2(4.8).這說明存在Ca2+時ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的吸附能力明顯強于ZrO2(4.8).采用線性化Langmuir、Freundlich和D-R等溫吸附模型對圖 5實驗數(shù)據(jù)進行線性擬合,計算得到的各等溫吸附模型的參數(shù)和相關系數(shù) (R2) 見表 3.根據(jù)各模型參數(shù)計算得到的等溫吸附線亦見圖 5.由表 3和圖 5可見,存在Ca2+條件下,Langmuir、Freundlich和D-R等溫吸附模型均可以用于描述ZrO2(4.8)、ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的吸附平衡數(shù)據(jù).根據(jù)Langmuir模型計算得到的ZrO2(4.8)、ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的最大單層吸附量分別為41.2、68.9和83.4 mg ·g-1.這說明存在Ca2+條件下ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的飽和吸附容量明顯大于ZrO2(4.8).根據(jù)計算得到的Langmuir模型RL值以及Freundlich模型1/n值,存在Ca2+條件下3種不同沉淀pH值時所得水合氧化鋯對水中磷酸鹽的吸附屬于優(yōu)惠吸附.根據(jù)D-R模型計算得到的E值均大于8 kJ ·mol-1,這證實了存在Ca2+條件下ZrO2(4.8)、ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的吸附反應屬于化學吸附而不是物理吸附.

圖 5 存在Ca2+條件下不同沉淀pH值時所得水合氧化鋯對水中磷酸鹽的吸附等溫線
表 3 存在Ca2+條件下水合氧化鋯對磷酸鹽的吸附等溫線擬合參數(shù)和相關系數(shù)
當溶液中Ca2+和磷酸鹽共存時,磷酸鈣沉淀物可能會形成.如果磷酸鈣沉淀物形成的話,那么水合氧化鋯去除水中磷酸鹽的機制包括吸附和沉淀.如果磷酸鈣沉淀物沒有形成的話,那么水合氧化鋯去除水中磷酸鹽主要靠吸附作用.為檢驗實驗條件下溶液中磷酸鈣沉淀物是否形成,對靜置24 h后含Ca2+和磷酸鹽溶液 (Ca2+濃度為2 mmol ·L-1、磷酸鹽濃度為10~60 mg ·L-1、pH值為7.0) 中磷酸鹽濃度進行了監(jiān)測分析,結果發(fā)現(xiàn),靜置24 h后含Ca2+和磷酸鹽溶液中磷酸鹽濃度與初始磷酸鹽濃度基本一致.這說明實驗條件下磷酸鈣沉淀不會發(fā)生,水合氧化鋯去除水中磷酸鹽的機制主要為吸附作用.
2.6 不存在Ca2+條件下同水合氧化鋯吸磷機制的對比分析
綜合分析離子強度對吸附的影響、吸附前后溶液pH值的變化以及平均吸附自由能等結果,并結合分析先前研究報道,得到結論:不存在Ca2+條件下ZrO2(4.8)、ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的吸附機制主要為配位體交換和內層配合物形成.不同沉淀pH值條件下制備的水合氧化鋯與水中磷酸鹽之間發(fā)生配位體交換的配位體類型是不同的.有研究表明,水合氧化鋯表面吸附的氯和羥基基團均可以作為配位體與水中磷酸鹽發(fā)生配位體交換.因此,ZrO2(4.8) 和ZrO2(8.0) 表面與水中磷酸鹽發(fā)生交換的配位體主要為氯和羥基基團,而ZrO2(10.6) 表面與水中磷酸鹽發(fā)生交換的配位體主要為羥基基團.水合氧化鋯與水中磷酸鹽之間的化學反應可以采用方程式 (9)~(11) 加以描述.
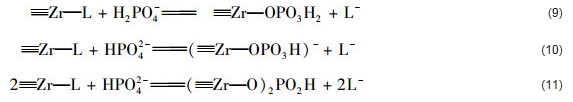
式中,對于ZrO2(4.8) 和ZrO2(8.0) 而言,L是指Cl和—OH;對于ZrO2(10.6) 而言,L是指—OH.
2.7 Ca2+對水合氧化鋯吸附水中磷酸鹽的影響機制
存在Ca2+條件下,水中磷酸鹽仍然可以通過配位體交換作用被直接吸附到水合氧化鋯表面上形成先前的研究已經(jīng)發(fā)現(xiàn),當溶液pH大于金屬氧化物的pHPZC時,Ca2+可以被吸附到金屬氧化物的表面.當初始pH值為7時,ZrO2(8.0) 和ZrO2(10.6) 表面帶負電荷.因此,當初始pH值為7時,Ca2+可以被吸附到這2種水合氧化鋯表面上,并且可以采用方程式 (12)~(15) 加以描述.
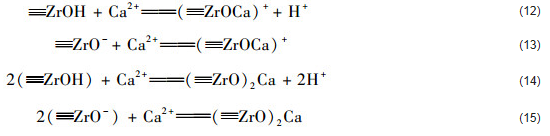
先前的研究已經(jīng)發(fā)現(xiàn)Ca2+被吸附到磷酸鹽負載水合氧化鋯表面上可以促進沉淀pH值為7.0條件下所得水合氧化鋯對水中磷酸鹽的吸附.為證實Ca2+被吸附到磷酸鹽負載水合氧化鋯表面是否會促進ZrO2(8.0) 和ZrO2(10.6) 對水中磷酸鹽的吸附,本文對比分析了磷酸鹽負載水合氧化鋯和先磷酸鹽負載再Ca2+負載水合氧化鋯對水中磷酸鹽的吸附能力.結果發(fā)現(xiàn),磷酸鹽負載ZrO2(8.0) 和先磷酸鹽負載后Ca2+負載ZrO2(8.0) 對水中磷酸鹽的單位吸附量分別為15.5 mg ·g-1和17.6 mg ·g-1.這證實了Ca2+被吸附到磷酸鹽負載水合氧化鋯表面上促進了ZrO2(8.0) 對水中磷酸鹽的吸附.磷酸鹽負載ZrO2(10.6) 和先磷酸鹽負載后Ca2+負載ZrO2(10.6) 對水中磷酸鹽的單位吸附量分別19.7 mg ·g-1和11.6 mg ·g-1.這證實Ca2+被吸附到磷酸鹽負載水合氧化鋯表面上不會促進ZrO2(10.6) 對水中磷酸鹽的吸附.具體參見污水寶商城資料或http://www.jianfeilema.cn更多相關技術文檔。
根據(jù)化學平衡計算軟件Visual MINTEQ3計算確定,當溶液pH值為7時,Ca2+和磷酸鹽共存溶液中一部分磷會以CaHPO40形式存在.先前的研究已經(jīng)表明[38],與H2PO4-和HPO42-相比,以CaHPO40形式存在的磷酸鹽更容易被吸附到水合金屬氧化物表面.因此,Ca2+和磷酸鹽共存溶液中CaHPO40的形成會促進沉淀pH值8.0和10.6時所得水合氧化鋯對水中磷酸鹽的吸附.
綜上分析,共存Ca2+促進ZrO2(8.0) 對水中磷酸鹽吸附的原因主要是Ca2+被吸附到磷酸鹽負載水合氧化鋯表面上形成三元配合物溶液共存Ca2+條件下,ZrO2(8.0) 對水中磷酸鹽的吸附反應可以通過方程式 (9)、(10)、(11)、(16) 和 (17) 加以描述,而ZrO2(10.6) 對水中磷酸鹽的吸附可以通過方程式 (9)、(10)、(11) 和 (17) 加以描述.
式中,對于ZrO2(8.0) 而言,L是指Cl和——OH;對于ZrO2(10.6) 而言,L是指——OH.
3 結論
(1) 溶液共存的Na+僅略微促進了沉淀pH值為4.8和8.0時所得水合氧化鋯對磷酸鹽的吸附,卻會明顯促進了沉淀pH值為10.6時所得水合氧化鋯對磷酸鹽的吸附.
(2) 溶液共存的Ca2+僅略微促進了沉淀pH值為4.8時水合氧化鋯對磷酸鹽的吸附,卻會極大地促進了沉淀pH值為8.0和10.6時水合氧化鋯對磷酸鹽的吸附.
(3) 溶液共存的HCO3-和SO42-抑制了水合氧化鋯對磷酸鹽的吸附,且它們對沉淀pH值為4.8時所得水合氧化鋯吸附磷酸鹽的抑制作用明顯大于對沉淀pH值為8.0和10.6時水合氧化鋯的抑制作用.
(4) 隨著溶液pH值的增加,不同沉淀pH條件下制備的水合氧化鋯對水中磷酸鹽的吸附能力均隨之下降.
(5) Langmuir、Freundlich和D-R等溫吸附模型均可以用于描述不同沉淀pH條件下所得水合氧化鋯對水中磷酸鹽的吸附平衡數(shù)據(jù).存在Na+而不存在Ca2+情況下,3種不同沉淀pH值條件下所得水合氧化鋯對中性溶液中磷酸鹽的最大單層吸附容量差別不大,而存在Ca2+情況下,沉淀pH值為8.0和10.6時所得水合氧化鋯對中性溶液中磷酸鹽的最大單層吸附容量遠遠高于沉淀pH值為4.8時制備的水合氧化鋯.
(6) 沉淀pH值為4.8和8.0時所得水合氧化鋯的吸磷機制主要是表面氯和羥基基團與磷酸鹽之間的配位體交換作用,而沉淀pH值為10.6時所得水合氧化鋯的吸磷機制主要是表面羥基基團與磷酸鹽之間的配位體交換作用.