20世紀90年代,荷蘭的Mulder等在處理工業廢水的反硝化流化床中發現了一種新型細菌——厭氧氨氧化細菌 (anaerobic ammonia oxidation bacteria,AnAOB).該類細菌可以在缺氧條件下以亞硝酸鹽為電子受體將氨氮轉化為氮氣. 1999年,Strous等采用密度梯度離心法成功分離了AnAOB菌株,并通過16S rRNA基因測序,確認了AnAOB是浮霉狀菌的成員.
與傳統的硝化反硝化工藝相比,厭氧氨氧化 (anaerobic ammonia oxidation,ANAMMOX) 工藝具有無需外加碳源和供氧動力消耗,反應過程中CO2排放量少和剩余污泥產量少等優點.目前該工藝已經用于高氨氮工業廢水的處理中,如污泥消化液、垃圾滲濾液和養豬場廢水等.
厭氧氨氧化工藝雖然有諸多優點,但AnAOB生長緩慢,倍增時間為7~22 d,導致ANAMMOX反應器啟動時間長,是限制厭氧氨氧化工藝大規模應用的最主要因素.因此,選擇合適的反應器,減少AnAOB的流失,是成功應用厭氧氨氧化工藝的關鍵.目前,用于厭氧氨氧化技術的反應器有上流式污泥床反應器 (USB)、批序式間歇反應器 (SBR)和厭氧折流板反應器 (ABR)等.本實驗選擇上流式厭氧過濾床反應器 (upflow blanket filter, UBF),UBF反應器是由 (上流式污泥床) USB和厭氧過濾器 (AF) 構成的復合式反應器,具有良好的生物截留能力和易形成顆粒污泥等特點.
AnAOB至今仍未獲得人工的純培養,而高通量測序技術的發展為鑒定環境中的微生物群落的多樣性提供了有力的工具.本研究采用Illumina Hisep PE250測序平臺對UBF厭氧氨氧化反應器內的微生物進行高通量測序,分析了ANAMMOX反應器內微生物的分布情況,以期為ANAMMOX反應器內微生物群落相對豐度及群落結構變化提供理論依據.
1 材料與方法1.1 實驗裝置
反應器為UBF厭氧氨氧化反應器,由有機玻璃制成,呈圓柱形,總容積為3.94 L,有效容積為2.1 L,直徑為8 cm,總高度為66 cm,內置20 cm高的填料層,外裹黑布,避免光對厭氧氨氧化菌的抑制.廢水通過蠕動泵從反應器的底部連續泵入,與污泥混合后,反應生成的氣體從反應器頂部的排氣孔排出,出水由反應器上部的溢流堰流出.進水pH控制在7.1~7.8,在常溫條件下啟動.實驗裝置如圖 1所示.

圖 1 實驗裝置示意
1.2 接種污泥和實驗用水
反應器接種污泥來自廣州市瀝滘污水處理廠缺氧池,接種量為800 mL.
實驗采用模擬廢水,主要成分為NH4Cl和NaNO2,其濃度按實驗需要添加.其它成分為:NaHCO3 1 000 mg ·L-1,MgSO4 ·7H2O 473 mg ·L-1,CaCl2 ·2H2O 180 mg ·L-1,KH2PO4 27 mg ·L-1,微量元素Ⅰ1 mg ·L-1和微量元素Ⅱ 1 mg ·L-1.其中微量元素Ⅰ為:EDTA 5 000 mg ·L-1和FeSO4 ·7H2O 5 000 mg ·L-1.微量元素Ⅱ為:ZnSO4 ·7H2O 430 mg ·L-1,GuSO5 ·5H2O 240 mg ·L-1,MnCl2 ·4H2O 990 mg ·L-1,NiCl2 ·6H2O 190 mg ·L-1,CoCl2·6H2O 24 mg ·L-1.進水pH值用鹽酸調節為7.1~7.8.
1.3 水樣檢測方法
氨氮:納氏試劑分光光度法;亞硝氮:N-(1-萘基)-乙二胺光度法;硝氮:紫外分光光度法;總氮為氨氮、亞硝氮和硝氮之和;pH值采用pH計測定.
1.4 微生物群落多樣性檢測方法1.4.1 DNA提取
反應器運行至第54 d時取下層污泥20 mL (標記為CYR110,文中表示富集階段),此時污泥高度為19.6 cm.第83 d時分別取上層污泥 (標記為CYR111) 和下層污泥 (標記為CYR112,文中表示穩定運行階段) 各20 mL,此時污泥高度為24.4 cm.下層污泥的取樣口距離底部4.4 cm,上層污泥的取樣口距離底部20.7 cm.采用Powersoil土壤DNA提取試劑盒提取基因組DNA.提取的DNA使用瓊脂糖凝膠電泳檢測DNA純度,使用Nanodrop檢測DNA濃度.
1.4.2 PCR擴增
采用16S rRNA V4區通用引物,引物序列為515F 5′-GTGCCAGCMGCCGCGGTAA-3′和806R 5′-GGACTACHVGGGTWTCTAAT-3′,擴增片段大小為300bp左右.采用PCR儀對細菌16S rRNA基因進行PCR擴增,擴增反應體系 (60 μL) 為10x Ex Taq Buffer 6 μL,dNTP 6 μL,BSA 0.6 μL,Ex Taq 0.3 μL,Primer F 1.2 μL,Primer R 1.2 μL,DNA 1 μL,ddH2O 43.7 μL.按照PCR反應條件 (94℃ 5 min,94℃ 30 s,52℃ 30 s,72℃ 45 s,72℃ 10 min) 進行,31 Cycles PCR完成后利用瓊脂糖凝膠電泳檢測擴增產物.
1.4.3 Illumina高通量測序
采用Illumina Hisep PE250測序平臺對采集的樣品進行高通量測序.
1.4.4 數據處理分析方法
采用Origin 7.5和AutoCAD 2007軟件繪制圖,并采用SPSS 19.0(IBM Inc,USA) 軟件對數據進行分析.
2 結果與討論2.1 反應器的脫氮性能
反應器運行至第54d時,保持HRT為8h不變,以提高進水NH4+-N和NO2--N濃度的方式增大反應器的容積負荷,此時NH4+-N、NO2--N和TN的去除率分別為76.18%、53.47%和55.66%,總氮容積負荷和去除負荷分別為0.56 kg ·(m3 ·d)-1和0.29 kg ·(m3 ·d)-1.當反應器運行至第83 d時,NH4+-N、NO2--N和TN的去除率分別為99.4%、93.1%和82.8%,總氮容積負荷和去除負荷分別為1.25 kg ·(m3 ·d)-1和1.04 kg ·(m3 ·d)-1,說明反應器啟動成功.由圖 2可以看出,NH4+-N、NO2--N濃度和NLR呈梯度升高.當反應器的總氮容積負荷由0.52 kg ·(m3 ·d)-1增大至2.75 kg ·(m3 ·d)-1時,TN的去除率由55.66%增大至82.96%.蔣軍等研究表明,當反應器的容積負荷由0.21 kg ·(m3 ·d)-1增大至0.84 kg ·(m3 ·d)-1時,TN的去除率由67.98%減小至50.4%,與本研究結果有較大差異,可能與實驗裝置和反應條件有關.實驗的前40多天,出水中的NH4+-N和NO2--N濃度較穩定,分別在0~30 mg ·L-1和4~53 mg ·L-1之間波動.當進水NH4+-N和NO2--N濃度分別增大至240 mg ·L-1和300 mg ·L-1時,出水中的NH4+-N和NO2--N濃度有所增大,但增大幅度較小,通過降低進水的pH值,出水中的NH4+-N和NO2--N濃度經過1 d分別降低至0~10 mg ·L-1和15~30 mg ·L-1之間.隨著進水NH4+-N和NO2--N濃度的繼續增大,當進水NH4+-N和NO2--N濃度分別達到330 mg ·L-1和430mg ·L-1時,反應器出水水質突然惡化,出水的NH4+-N和NO2--N濃度分別增大至89 mg ·L-1和163 mg ·L-1.此時NH4+-N和NO2--N的去除率分別為73.0%和62.1%,此時厭氧氨氧化菌的活性受到抑制. Dapena-Mora等研究發現當NO2--N濃度達到350mg ·L-1時,厭氧氨氧化菌的活性會降低50%.在不同研究中,NO2--N對厭氧氨氧化菌的抑制濃度是不同,這可能與菌種及操作條件有關.為了較快地恢復反應器的脫氮性能,將進水NH4+-N和NO2--N濃度分別降低至310 mg ·L-1和400 mg ·L-1.經過7 d的恢復期,出水中的NH4+-N和NO2--N濃度分別降低至16 mg ·L-1和56 mg ·L-1,NH4+-N和NO2--N的去除率分別恢復至95.0%和86.6%.研究表明,NO2--N毒性顯著強于NH4+-N,在進水NO2--N濃度較高或進水NO2--N/NH4+-N相對較高的條件下,反應器性能易因基質抑制而失穩.

圖 2 ANAMMOX反應器的脫氮性能
2.2 ANAMMOX反應器微生物群落多樣性研究2.2.1 Alpha多樣性指數分析
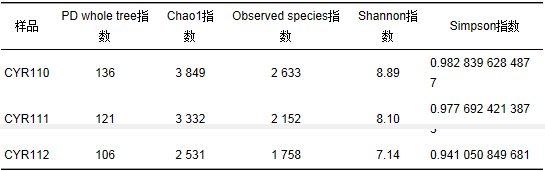
由Observed species和Chao1指數可知 (見表 1),富集階段反應器內的微生物群落相對豐度要高于穩定運行階段,而在穩定運行階段,反應器內的上層微生物群落相對豐度要高于下層,說明反應器內的微生物經過一段時間的馴化后,部分微生物適應不了無機厭氧環境而逐漸死亡,造成微生物的豐度降低.由PD whole tree、Shannon和Simpson指數可知 (見表 1),富集階段反應器內的微生物群落多樣性要高于穩定運行階段,而穩定運行階段反應器內的上層微生物群落多樣性要高于下層,說明反應器內的AnAOB經過一段時間的馴化后形成了優勢種群,導致微生物群落多樣性的減少.由于廢水是從反應器的底部泵入,因此反應器下層的AnAOB最先被馴化成優勢種群,因而下層的微生物群落多樣性要低于上層.
表 1 生物多樣性分析
2.2.2 門水平物種相對豐度分析
由圖 3可知,所測得的相對豐度大于等于1%的門隸屬于14個門.其中,富集階段反應器中的微生物主要以變形菌門Proteobacteria、擬桿菌門Bacteroidetes、綠彎菌門Chloroflexi、泉古菌門Crenarchaeota和廣古菌門Euryarchaeota為主,穩定運行階段反應器中的微生物主要以變形菌門Proteobacteria、擬桿菌門Bacteroidetes、綠彎菌門Chloroflexi和浮霉菌門Planctomycetes為主,反應器中的浮霉菌門和變形菌門有了明顯的增加,分別由1.1%、27.9%增加到了26.4%、39.9%.而擬桿菌門、綠彎菌門、泉古菌門和廣古菌門都明顯減少.反應器上下層物種相對豐度有明顯的差異.底部的浮霉菌門明顯比上層多,而上層的擬桿菌門要比底部多.

圖 3 門水平物種相對豐度分布
2.2.3 科水平物種相對豐度分析
由圖 4可知,所測得的相對豐度大于等于1%的科隸屬于21個科,其中,富集階段反應器中的微生物主要以厭氧蠅菌科Anaerolinaceae、紅環菌科Rhodocyclaceae、叢毛單孢菌科Comamonadaceae為主.穩定運行階段反應器中的上層污泥主要以厭氧蠅菌科Anaerolinaceae、紅環菌科Rhodocyclaceae、叢毛單孢菌科Comamonadaceae和Brocadiaceae為主,下層污泥主要以厭氧蠅菌科Anaerolinaceae、紅環菌科Rhodocyclaceae、叢毛單孢菌科Comamonadaceae、黃單胞菌科Xanthomonadaceae和Brocadiaceae為主.反應器中的厭氧蠅菌科Anaerolinaceae、甲烷絲狀菌科Methanosaetaceae、WSA2、腐螺旋菌科Saprospiraceae、熱孢菌科Thermotogaceae和互營菌科Syntrophaceae有明顯的減少,其中WSA2、腐螺旋菌科Saprospiraceae、熱孢菌科Thermotogaceae和互營菌科Syntrophaceae在穩定運行階段幾乎看不到.而紅環菌科Rhodocyclaceae、叢毛單孢菌科Comamonadaceae、黃單胞菌科Xanthomonadaceae和Brocadiaceae有了明顯的增加,其中Brocadiaceae增加最為顯著,由0.074 6%增加到了24.572 7%.反應器上層Brocadiaceae占12.486 9%,下層占24.572 7%,下層Brocadiaceae的豐度明顯比上層高. Brocadiaceae屬于浮霉菌門下的一個科,已出現的厭氧氨氧化菌主要來自于這個科.由此可知,厭氧氨氧化反應器經過一段時間的運行后,反應器中的厭氧氨氧化微生物明顯增加了.而反應器下層的厭氧氨氧化微生物明顯比上層高.

圖 4 科水平物種相對豐度分布
2.2.4 物種相對豐度熱圖分析
由圖 5可知,穩定運行階段的下層污泥中的Brocadiaceae、噬纖維菌科Cytophagaceae、叢毛單胞菌科Comamonadaceae、SB1、黃單胞菌科Xanthomonadaceae、慢生根瘤菌科Bradyrhizobiaceae、A4b、Haliangiaceae、Cryomorphaceae、生絲微菌科Hyphomicrobiaceae群落相對豐度要比上層高,其中,上層污泥中的Brocadiaceae、噬纖維菌科Cytophagaceae、叢毛單胞菌科Comamonadaceae、SB1群落相對豐度要比富集階段高.相反,富集階段反應器中的熱袍菌科Thermotogaceae、互營桿菌科Syntrophobacteraceae、Syntrophorhabdaceae、互營菌科Syntrophaceae、腐螺旋菌科Saprospiraceae、WSA2、甲烷絲狀菌科Methanosaetaceae、甲烷桿菌科Methanobacteriaceae、厭氧蠅菌科Anaerolinaceae、暖蠅菌科Caldilineaceae、肉桿菌科Carnobacteriaceae群落相對豐度要比穩定運行階段高.總體來看,富集階段反應器內的微生物群落結構與穩定運行階段相比相差很大,而穩定運行階段反應器上下層的微生物群落結構也有較大的差異. Chen等研究表明ABR厭氧氨氧化反應器各隔室的微生物群落結構存在較大的差異, 與本研究結果相符.

圖 5 物種相對豐度聚類 (科水平)
2.2.5 脫氮細菌多樣性分析
通過高通量的擴增子測序,共鑒定出門的細菌40種.其中,涉及到脫氮細菌的有變形菌門、浮霉菌門和硝化螺旋菌門3種,變形菌門豐度最高,與多數厭氧氨氧化反應器微生物群落分布情況相一致.
在變形菌門中,富集階段的樣品中共鑒定出屬的細菌67種,占據比例較高的是陶厄氏菌屬Thauera(1.532%)、Dok59(1.318%)、Thibacillus硫桿菌屬 (0.888%) 和互營桿菌屬Syntrophobacter(0.650%).穩定運行階段的上層污泥樣品中共鑒定出屬的細菌56種,占據比例較高的是Dok59屬 (4.644%)、Thauera屬 (2.560%)、Thibacillus屬 (1.074%) 和脫硫微菌屬Desulfomicrobium(0.923%),穩定運行階段的下層污泥樣品中共鑒定出屬的細菌54種,占據比例較高的是Dok59屬 (6.014%)、Thauera屬 (1.447%)、Thibacillus屬 (0.638%) 和Thermomonas屬 (0.503%).變形菌門中屬的細菌多樣減小. Thauera屬、Dok59屬和Thibacillus屬豐度最高,其中Thauera屬和Thibacillus屬是β-變形菌綱中的反硝化細菌.此外,富集階段的樣品中只檢測出Nitrosovibrio這一種氨氧化細菌 (AOB),僅占0.011%,屬于β-變形菌亞綱. AOB屬于能夠在有氧條件下將氨氧化為亞硝酸鹽的化能無機自養型細菌.本實驗裝置沒有專門的除氧設備,因此會伴隨有少量的氧氣進入反應器中為AOB提供有氧環境.由圖 6可以看出,ΔNO2--N/ΔNH4+-N值在最初的10 d由0.60增大至1.31,然后在1.05~1.41之間波動. ΔNO3--N/ΔNH4+-N值在最初的10 d由0.22增大至0.44,然后逐漸減小至0.15.說明富集階段部分NH4+-N被AOB轉化為亞硝酸鹽.而穩定運行階段的ΔNO2--N/ΔNH4+-N值較接近理論值1.32,說明此時NH4+-N幾乎全部由AnAOB所利用.

圖 6 3種氮素的比值變化
硝化螺旋菌門是測序得到的三大脫氮細菌門中所占比例最小的,在0.035%~0.188%之間,富集階段的含量最高 (0.188%).推測富集階段的AOB將部分氨轉化為亞硝酸鹽,導致剩余亞硝酸鹽的積累,而硝化螺旋菌門是亞硝化反應的主要微生物,因此含量高于穩定運行階段.在硝化螺旋菌門中,共鑒定出2種屬的細菌,分別為GOUTA19和Nitrospira,其中,Nitrospira為亞硝鹽氧化細菌 (NOB),所占比例在0.023%~0.174%之間,富集階段的含量最高 (0.174%).推測富集階段的AOB將部分氨轉化為亞硝酸鹽,導致剩余亞硝酸鹽的積累,而NOB可將亞硝酸鹽氧化為硝酸鹽,因此含量高于穩定運行階段.
在浮霉菌門中共鑒定出屬的細菌5種,分別為Gemmatia、A17、Pirellula、Planctomyces、Candidatus brocadia,其中,Candidatus brocadia所占的比例最高,在0.011%~1%之間.穩定運行階段Candidatus brocadia所占的比例 (1%) 高于富集階段 (0.011%),與穩定運行階段的去除負荷1.04kg ·(m3 ·d)-1高于富集階段0.29 kg ·(m3 ·d)-1相一致. Candidatus brocadia屬是第一個被富集鑒定的AnAOB[25],屬于Brocadiaceae科.而屬于Brocadiaceae科的96%序列通過BLAST進行序列比對發現與多條序列同源性相似,因此無法確定是哪種屬.推測未分類菌屬中可能含有未鑒定出的AnAOB新種.具體參見污水寶商城資料或http://www.jianfeilema.cn更多相關技術文檔。
3 結論
(1) 采用提高進水NH4+-N和NO2--N濃度的方式將ANAMMOX反應器的容積負荷由0.52 kg ·(m3 ·d)-1增大至2.75 kg ·(m3 ·d)-1,NH4+-N、NO2--N和TN的去除率分別從76.18%、53.47%、55.66%增大至94.04%、86.97%、82.96%,AnAOB成功富集.
(2) 由Alpha多樣性指數分析可知,反應器富集階段的微生物群落相對豐度和群落多樣性要高于穩定運行階段,而在穩定運行階段,反應器內的上層微生物群落相對豐度和群落多樣性要高于下層.
(3) 由門水平物種相對豐度分析可知,反應器中的浮霉菌門和變形菌門有明顯的增加,其中,浮霉菌門的豐度增大最為顯著.反應器底部的浮霉菌門明顯比上層多,而上層的擬桿菌門要比底部多.由科水平物種相對豐度分析可知,反應器富集階段以厭氧蠅菌科的相對豐度最高,為9.47%.穩定運行階段Brocadiaceae的相對豐度最高,達到了24.57%,成為優勢菌群.
(4) 由物種相對豐度熱圖分析可知,富集階段的微生物群落結構與穩定運行階段相比相差很大,而穩定運行階段反應器上下層微生物群落結構也有較大的差異.
(5) 由測序結果可知,穩定運行階段UBF厭氧氨氧化反應器中的脫氮細菌較為豐富,其中變形菌門、浮霉菌門和硝化螺旋菌門分別占39.9%、26.4%和0.188%.變形菌門中占據比例較高的是Dok59屬、Thauera屬、Thibacillus屬和Thermomonas屬.浮霉菌門主要包含Candidatus brocadia.