1 引言
油品加工、電鍍、冶煉、皮革制造及金屬加工等行業的廢水排放造成了水體中嚴重的重金屬污染.大氣沉降及土壤淋洗同樣是水體重金屬污染的重要來源.隨著進入到河流、湖泊中的重金屬離子越來越多,它們最終遷移到水底沉積物后更加難以治理.目前,我國的重金屬污染問題日益嚴峻,全國土壤重金屬污染數據十分龐大,并成為敏感話題.相比于去除土壤中的重金屬代價,水中重金屬的去除相對容易且也十分緊迫.然而水中重金屬的污染去除仍是當前環境治理的難點,研究表明,用無毒無害生物吸附劑可以有效去除重金屬污染,同時可以避免化學試劑的二次污染.
目前,國內外水處理技術的發展方向中,“綠色”治理占有很大的比例.因具有成本低廉、吸附速度快、應用潛力大及易于推廣等優點,各國學者都致力于選擇本土的、廣泛存在的生物材料,中國是世界竹類植物的起源地與種植中心,被稱為“世界竹子之鄉”.且竹子生長十分快速、產量驚人,使用過的竹子經歷風吹日曬后,老化十分快,且失去韌性,成為大量的廢棄物,同時也可被作為潛在的生物吸附劑原料.
基于此,本研究使用強性無機酸對枯竹子進行炭化,制備功能性的生物質炭,并使用微波輻照的方式將其與磁性鐵氧化物復合成磁性竹基炭,并以Pb2+、Cd2+與Cu2+分別作為水中吸附處理的對象,研究其吸附的影響因素、吸附性能及機理.
2 實驗部分
2.1 磁性活性炭制備
清洗干凈的枯竹子經粉碎、過篩(0.25 mm),在105 ℃下烘干24 h,得到干竹粉.向干竹粉中依次加入一定質量的濃硫酸(98%)和濃硝酸(67%),使其質量比(竹粉∶H2SO4 ∶ HNO3)為6∶ 15∶8.竹粉被炭化的同時也被無機酸活化,得到具有活性的炭粉末.遂將此粉末與20 mL的乙二醇溶液混合并加入0.375 g氯化鐵試劑和一定量的無水乙酸鈉,在功率為400 W的微波下照射25 min,由此獲得結合有納米Fe3O4的磁性竹基炭復合物(BBMC).由于磁性材料的特殊分離功能,使其在運用的過程中十分簡便,易于后期處理.最后,分別用紅外光譜儀(FTIR,Shimadzu公司)和場發射掃描電子顯微鏡(S-4800型FESEM,Shimadzu公司)對獲得的BBMC進行表征.
2.2 吸附實驗
吸附動力學實驗在HZS-H25水浴振蕩器中進行,條件如下:溫度30 ℃,pH值為4.0,吸附劑投加量為50 mg,3種金屬離子(Pb2+、Cd2+和Cu2+)的初始濃度均為10 mg · L-1,溶液的體積為100 mL.分別于第5、15、30、45、60、75、90 min時采樣測定溶液中的離子濃度.
樣品取樣方法:取適量的混合液到燒杯中,燒杯的一側放置一強永磁鐵,在很短時間內磁性吸附劑完全被分離,取透明溶液作為測試金屬離子的樣品.
在pH值、溫度、離子強度及金屬離子初始濃度的條件影響實驗中,首先控制吸附時間為90 min,依次改變所分析因素的單一變量,進行批次研究,每一個條件優化前按照動力學實驗的因素條件進行.
等溫吸附實驗在溫度為30 ℃,pH為5,吸附劑用量50 mg,平衡吸附時間為90 min的恒溫振蕩(200 r · min-1)條件下進行.3種金屬離子溶液(Pb2+、Cd2+和Cu2+)的初始濃度分別設為2、4、6、8、10、15 mg · L-1,進行批次平衡吸附實驗,記錄平衡吸附數據.
金屬離子濃度通過AA320N型原子吸收分光光度計測定(稀釋后的離子濃度),吸附量按以下公式計算:
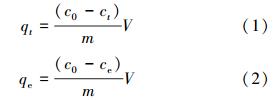
式中,qt、qe分別表示在吸附t時及平衡時的吸附量(mg · g-1),c0為離子的初始濃度(mg · L-1),ct、ce分別表示吸附t時后及平衡時溶液中離子的濃度(mg · L-1),V為溶液的體積(L),m為吸附劑投加量(g).
3 結果與討論
3.1 磁性生物質炭的表征
SEM被用來表征磁性竹基炭(BBMC)的表面形貌(圖 1).由圖 1可知,BBMC的主體是寬度為0.8 μm左右、厚度為納米級的薄片層結構,而磁性納米Fe3O4為顏色較亮的部分.BBMC片層的大小及形貌與石墨烯的SEM圖十分相似.因為竹粉經過濃硫酸浸泡活化,所以BBMC片層表面都有許多含氧、含氫氧基團.經過微波照射而不是高溫加熱的BBMC,表現出了不同于一般的活性炭的形貌和特征,而是類似石墨片的特性,此材料能夠為吸附質提供大量的表面活性位點.

圖 1 BBMC的SEM圖
BBMC吸附金屬陽離子前后的FTIR光譜見圖 2. 3434 cm-1處強的吸收峰源于—OH的伸縮振動,而1620 cm-1及1500 cm-1左右的吸收帶對應的是C C和C O振動.1050 cm-1處出現的強吸收峰是源于C—O伸縮振動,而633 cm-1左右的吸收帶反映了C—H的彎曲振動,579 cm-1處的微弱吸收峰源于Fe—O的伸縮.BBMC的FTIR譜圖說明了BBMC雜合了鐵氧化物,且表面存在許多含H的基團,確定了BBMC表面富有—COOH、—OH.BBMC吸附Pb2+、Cd2+和Cu2+金屬陽離子后的紅外光譜與吸附前的BBMC紅外譜相比在—OH的吸收峰處顯著變寬,說明了金屬離子對—O—H有化學作用.

圖 2 BBMC吸附重金屬前后的FTIR譜圖
3.2 BBMC對金屬離子吸附的動力學
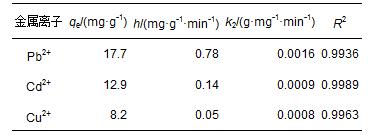
BBMC對金屬離子(Pb2+、Cd2+及Cu2+)的吸附量隨時間的變化如圖 3所示.由圖 3可知,吸附開始時,吸附速率迅速增加,隨著吸附時間的增加吸附速率逐漸降低,吸附容量趨于飽和.當吸附時間到達75 min時,吸附容量不再增加,吸附達到表觀平衡狀態.上述實驗現象初步表明,該吸附過程符合準二級動力學特征.實驗數據用準二級動力學方程(3)、(4)進行擬合.
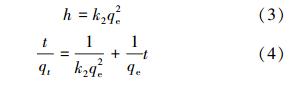
式中,qt為t時的吸附量(mg · g-1),qe這里表示計算平衡吸附量(mg · g-1),h是指吸附的初始吸附速率(mg · g-1 · min-1),k2是準二級速率方程的速率常數(g · mg-1 · min-1).3種金屬離子的擬合方程的可決系數均大于0.99,證明該吸附確實符合準二級動力學過程.擬合方程的相關常數列于表 1.由表中可以看出,實驗的表觀平衡吸附量接近方程的平衡吸附值.此外,對比3種離子吸附的不同,Pb2+的吸附速率及吸附容量均略高于Cd2+和Cu2+,其中,Cu2+的吸附速率及吸附量最低.
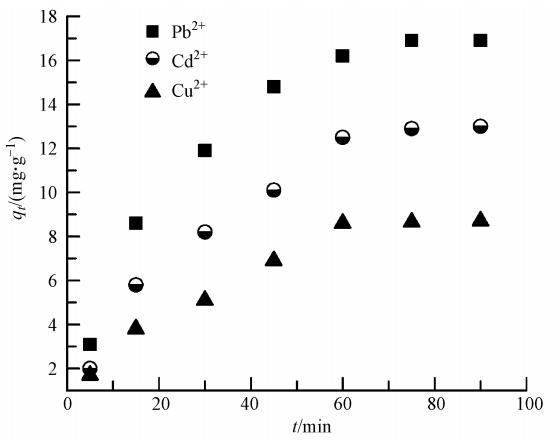
圖 3 不同時刻Pb2+、Cd2+和Cu2+在BBMC上的吸附量
表1 Pb2+、Cd2+與Cu2+的準二級吸附動力學參數
3.3 影響BBMC對金屬離子吸附的因素及其機理
3.3.1 pH值
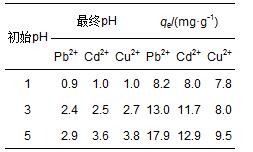
一般來說,溶液介質的pH值對吸附劑的吸附能力有明顯的影響.為了證明pH值的影響機制,首先比較了BBMC與不加入炭粉而制備的磁性Fe3O4的吸附能力.pH值分別設置為1、3和5,振蕩吸附90 min后取樣,測定其最終pH值及平衡吸附量.實驗表明,磁性Fe3O4對3種金屬離子幾乎完全無吸附能力,吸附前后pH值無變化.BBMC對Pb2+、Cd2+和Cu2+的平衡吸附量見表 2.首先,隨著溶液中H+的初始濃度呈對數降低,金屬離子吸附后,溶液中pH增加更明顯.其次,吸附前后pH值的降低與金屬離子吸附量的增加呈正向變化關系.我們判斷此吸附的機理是金屬陽離子與BBMC表面H+之間的離子交換.
表2 不同初始pH值時3種金屬離子在BBMC上的吸附量及溶液最終pH值
低的pH值對吸附有負影響是因為大量存在的水合氫離子與BBMC表面的含氧基團之間的氫鍵作用,占據了吸附位點,阻礙了離子交換作用.Pb2+、Cd2+與Cu2+的離子半徑分別為0.119、0.078和0.057 nm.因為在3種正二價金屬陽離子中,Pb2+水合離子半徑最小且堿性較弱不容易發生水解,在溶液中傳質阻力小,所以更容易進行離子交換.
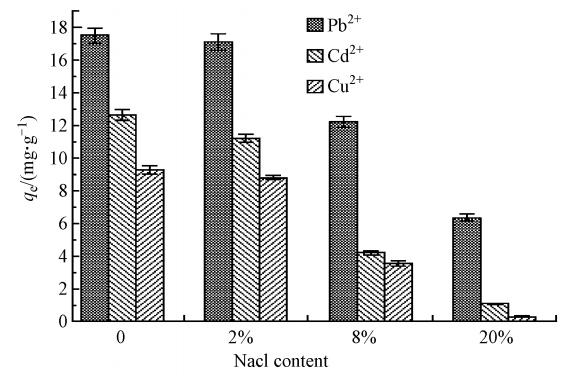
圖 4 NaCl濃度對金屬離子吸附的影響
3.3.2 離子強度
通過加入不同濃度的NaCl來探究離子強度對金屬離子交換吸附的影響.實驗(圖 4)表明,加入2%的NaCl后,BBMC對3種金屬陽離子的吸附幾乎無影響;當NaCl的濃度為8%時,3種金屬離子的吸附量都開始下降;而加入20%的NaCl,Cd2+與Cu2+幾乎沒有被吸附,而Pb2+的吸附量從17.9 mg · g-1降低到6.5 mg · g-1,降低了63.7%.可見,高濃度電解質離子阻礙了BBMC對金屬離子的吸附.當吸附能力隨著離子強度增加而減小時,離子與吸附劑表面之間形成的是外層表面絡合(OSSC)作用,具體見圖 5.離子強度影響的機理被認為是電解質離子與金屬離子發生了競爭吸附,因為大量存在的鈉離子占據了吸附位點,此外,陽離子間相互斥力也阻礙了重金屬離子與BBMC接觸.
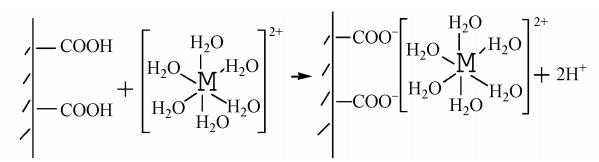
圖 5 金屬離子交換的外層表面絡合作用模型
3.3.3 溫度
通過設置4個梯度的溫度,在恒溫振蕩吸附90 min后,測定BBMC對3種金屬離子的吸附量(圖 6).結果顯示,3種金屬陽離子在所有溫度下的平衡吸附量的變化都小于2%,即溫度對Pb2+、Cd2+與Cu2+在BBMC上的吸附幾乎沒有影響.
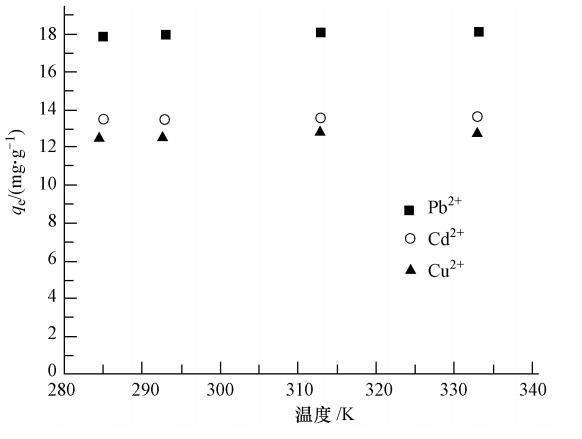
圖 6 溫度對吸附的影響
為了進一步探究吸附特性,選取金屬離子的6個不同初始濃度,在30 ℃恒溫下進行批次平衡吸附實驗,各初始濃度下的表觀平衡吸附量見圖 7.由圖可知,隨著金屬離子初始濃度的升高,3種離子的吸附量逐步增加.當金屬離子的初始濃度為10 mg · L-1時,吸附量都已經達到飽和,此時Pb2+、Cd2+與Cu2+的去除率分別為79.5%、69.5%和47.5%.
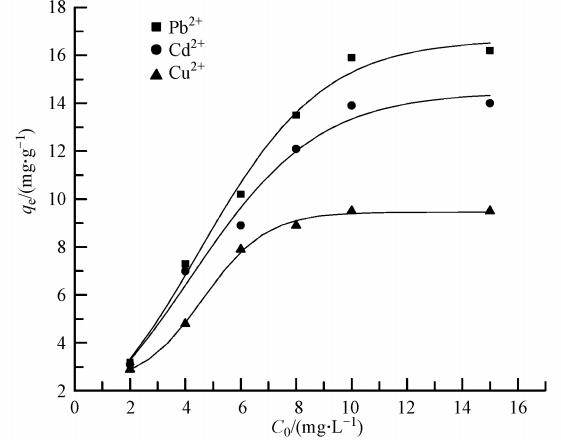
圖 7 不同初始濃度下3種陽離子的平衡吸附量
3.4 BBMC對金屬離子吸附的等溫模型建立
3種等溫模型(Langmuir、Freundlich和Dubinin-Radushkevich)被用來擬合吸附平衡時吸附量與吸附質濃度的關系.Langmuir模型適用于均質吸附劑的單層吸附,其單層的表面吸附位點有限且各吸附位點的能量相等.Langmuir模型的表達形式如下:
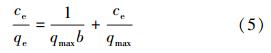
式中,qe表示平衡吸附量(mg · g-1),ce表示平衡濃度(mg · L-1),qmax是單層吸附的最大吸附量(mg · g-1),b是Langmuir模型的吸附平衡常數,反映了吸附時能量(L · g-1).
Freundlich模型一般適用于具有異質特性吸附劑的可逆吸附作用,Freundlich模型的表達形式如下:
式中,log KF(L · g-1)和1/n分別是與吸附量和吸附劑的吸附密度相關的系數.
Dubinin-Radushkevich等溫模型可以用來測定吸附平均自由能E,進一步證明吸附的機理.線性的D-R等溫式表示為:
式中,qm是計算的最大吸附量(mg · g-1),k是D-R常數(mol2 · kJ-2),表示polanyi 能(J · mol-1),它的計算式為:
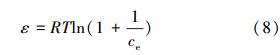
式中,R是大氣常數(J · mol-1 · K-1),T是絕對溫度(K).吸附的平均自由能的計算基于方程:
當吸附符合D-R模型,且E在8~16 kJ · mol-1之間時,為化學吸附;如果E<8 kJ · mol-1,為物理吸附.
3種等溫模型擬合的參數及線性關系見表 3.由表可知,此吸附均很好地符合Langmuir模型,其可決系數均大于0.99.同時,Pb2+的吸附特征也符合D-R模型.從Langmuir模型和D-R模型中獲得的最大吸附量值都十分接近(表 3),進一步證明了兩種模型的可靠性.雖然Cd2+和Cu2+的吸附數據用D-R模型擬合的可決系數小于0.9,但據E值仍可以粗略判斷3種陽離子吸附是化學過程,即BBMC上的氫與Pb2+、Cd2+以及Cu2+發生了離子交換作用.具體參見污水寶商城資料或http://www.jianfeilema.cn更多相關技術文檔。
表3 Pb2+、Cd2+及Cu2+在BBMC上吸附的3種等溫模型參數
4 結論
微波照射法合成的磁性竹基炭(BBMC),具有足夠的磁性并且富有H+的活性炭表面.該吸附劑對Pb2+、Cd2+及Cu2+有離子交換的吸附作用,使得簡便的、零耗能的金屬陽離子吸附分離成為可能.此材料對3種金屬離子中具有最小水合離子半徑的Pb2+吸附效果最好.低的pH值、高濃度的離子強度對吸附有負影響,而溫度對離子交換幾乎無影響.低成本,易回收處理的BBMC為具有強吸附力的磁性生物質材料作為綠色吸附劑開闊了前景.