1 引言(Introduction)
砷是一種半金屬元素, 無臭無味, 普遍存在于天然水體和工業廢水中, 并且被認為是毒性最大的無機污染物(Pena et al., 2005).無機狀態下的砷元素主要以亞砷酸根和砷酸根兩種形式存在于水體中, 且亞砷酸根的毒性比砷酸根高10倍(Katsoyiannis et al., 2007).長期暴露于高砷環境中會對人體產生重大危害(Pontius et al., 1994;Guha et al., 2003).世界衛生組織(WHO)規定飲用水中砷的最高限度為10 μg·L-1(Zhang et al., 2013), 我國的《生活飲用水衛生標準》也采用了這一標準(Nordstrom et al., 2002).因此高效的除砷技術成為了各國研究人員的研究熱點.目前, 飲用水處理中的除砷方法主要包括:化學沉淀(Dodd et al., 2006)、離子交換(Wang et al., 2000)、膜過濾(Teychene et al., 2013)、電混凝(Hansen et al., 2006)和吸附法(Sun et al., 2017;Gupta et al., 2010)等.其中, 吸附法由于簡單易行、處理效率高、成本低廉, 已成為當前最有應用前景的飲用水除砷方法之一(李定龍等, 2007).
近年來, 國內外研究者研制出了活性鋁(Lin et al., 2001)、鐵氧化物/氫氧化物(Feng et al., 2012)、二氧化鈦(Tang et al., 2012)、氧化鎂(Mohan et al., 2007)、二氧化鈰(Zhang et al., 2005)及還原性金屬(Mohan et al., 2007)等多種新型納米除砷吸附劑.其中, 鐵及其氧化物與砷離子具有更強的親和力(Lafferty et al., 2005), 且制備方法簡單, 原材料來源廣泛, 現已被廣泛研究.然而, 單一組份鐵氧化物與As(Ⅲ)的親和力大大弱于As(Ⅴ) (Sun et al., 2017;Zhang et al., 2007), 導致其難以高效去除水中的三價砷, 限制了其廣泛應用.為此, 利用雙組份吸附材料中兩種組份能產生協同效應的優勢, 研究者開發了一系列Fe-Mn(Shan et al., 2013;Zhao et al., 2012)、Fe-Ti(汪賽奇等, 2014)等鐵基納米復合材料.其中, TiO2由于顆粒小、比表面積大、光催化活性高、造價低廉且富含親水性的表面羥基, 可將其直接負載于磁性載體上(Liu et al., 2014).Yu等(2014)制備了γ-Fe2O3-TiO2納米吸附劑, 在紫外光下, 復合光催化吸附劑產生的羥基自由基能將As(Ⅲ)氧化為As(Ⅴ), 并將其進一步吸附于鐵氧化物表面, 達到除砷的目的.但由于TiO2與γ-Fe2O3復合掩蓋了鐵材料表面的活性吸附點位, 再加上另一組份TiO2材料對砷的吸附能力較低, 導致其整體除砷效能并不高.Rao等(2015)采用共沉淀法合成了Fe-Ti雙組份氧化物, 在最優條件下, 其對砷的飽和吸附量僅有31.42 mg·g-1.因此, 亟待尋求兼具良好光催化性能的同時對水中的砷離子有良好的吸附性能的材料, 與Fe3O4合成復合材料, 作為光催化劑和吸附劑用于高效處理水中砷污染.
CeO2作為稀土材料中一種高效經濟的光催化成分, 現已應用于光催化領域(Arul et al., 2013).同時, 由于對水中砷離子具有較強的親和力, 鈰基氧化物還被用于高效吸附去除水中砷離子(Gupta et al., 2012).鑒于此, 本研究利用CeO2半導體的光催化活性及CeO2和Fe3O4對As(Ⅴ)的強親和力, 合成鐵鈰雙組份磁性納米吸附除砷材料, 從而利用光催化作用將As(Ⅲ)氧化為As(Ⅴ), 進而考察水中As(Ⅲ)的去除效果及吸附除砷的影響因素, 在此基礎上, 研究了鐵鈰復合物的吸附特性.
2 材料與方法(Materials and methods)2.1 實驗材料
亞砷酸鈉(分析純)作為三價砷源, 購自北京化學試劑廠.硝酸鈰、尿素、氯化鐵、氯化亞鐵、氫氧化鈉、六亞甲基四胺等均為分析純(國藥集團化學試劑有限公司).所有的儲備液及溶液均采用超純水配制, As(Ⅲ)儲備液的濃度為1 g·L-1, 放于4 ℃冰箱中儲存備用.
2.2 Fe-Ce復合材料的制備
將4.34 g硝酸鈰和4.80 g尿素溶于150 mL超純水中, 放置于90 ℃恒溫水浴中, 持續攪拌12 h.反應后, 生成白色沉淀, 將白色懸濁液冷卻至室溫, 離心分離, 用超純水洗滌5次, 80 ℃真空干燥后, 置于馬弗爐中300 ℃焙燒2 h, 研磨成粉末, 即得二氧化鈰.
將1.99 g氯化亞鐵溶液和4.61 g氯化鐵溶液按摩爾比1:1.7加入400 mL超純水中, 攪拌使其完全溶解.再將1.72 g二氧化鈰和1 g六亞甲基四胺加入上述溶液, 并將其放置于80 ℃恒溫水浴, 持續磁力攪拌同時滴加0.1 mol·L-1的NaOH溶液, 直至溶液pH =10, 繼續攪拌2 h, 得到黑色沉淀, 陳化8 h, 過濾后用超純水洗滌至中性, 80 ℃真空干燥, 研磨后放入無水乙醇中保存備用.
2.3 材料表征
采用X射線衍射儀(Shimadzu XRD-6100, 日本)分析復合材料的晶型結構;采用掃描電子顯微鏡(Hitachi S-3500N, 日本)表征材料的表觀形貌;復合材料的比表面積、孔容和孔徑分布由比表面積測定儀(Micromeritics ASAP 2020, 美國)測定;采用振動樣品磁強計(JDM-13, 中國)對復合材料進行磁特性分析.
2.4 光催化/吸附實驗
Fe-Ce復合材料的光催化/吸附除砷實驗在常溫常壓下進行.以300 W紫外燈作為光源, 批量試驗的As(Ⅲ)濃度為10 mg·L-1, 吸附劑濃度為200 mg·L-1, 離子強度(以NaNO3計)為0.01 mol·L-1, 反應液初始pH為7.0.在石英管中加入50 mL 10 mg·L-1的As(Ⅲ)溶液和10 mg Fe-Ce復合材料, 將石英管置于光催化反應器(OCRS-IV TYPE)中, 在紫外光照射下, 以轉速為150 r·min-1持續磁力攪拌, 光反應30 min后, 關閉紫外光源, 繼續攪拌690 min, 以保證達到吸附平衡.定時取樣, 用0.45 μm微孔濾膜器分離去除水中納米顆粒, 用電感等離子體發射光譜(ICP-AES)測定濾液中的總砷濃度, 濾液中三價砷和五價砷的濃度采用離子色譜法測定.
3 結果與討論(Results and discussion)3.1 材料表征3.1.1 微觀形貌與晶體結構
利用掃描電子顯微鏡(SEM)觀察了Fe-Ce復合材料的微觀形貌.從圖 1中可以看出, Fe-Ce復合材料表面粗糙并呈現孔道結構, 復合材料顆粒為納米級非均勻粒子, 粒徑約為10~30 nm.X射線衍射分析(XRD)常用于材料的晶體結構分析, 如圖 2所示, 2θ在10°~80°范圍內, 呈現一系列特征衍射峰.其中一些衍射峰屬于Fe3O4 (JCPDs 88-0315)的(220)、(311)、(400)、(422)、(511)和(110)晶面.在33.4°、47.1°、51.7°、59.1°、69.7°和77.1°處的衍射峰均屬于CeO2 (JCPDs 65-5923), 這說明該合成材料由Fe3O4和CeO2組成, 即為CeO2-Fe3O4復合材料.
圖 1

圖 1 CeO2-Fe3O4復合材料的掃描電鏡圖
圖 2

圖 2 CeO2-Fe3O4復合材料的X射線衍射圖譜
3.1.2 材料的理化性質
CeO2-Fe3O4復合材料的氮氣吸附脫附曲線與孔徑分布分析結果如圖 3所示.CeO2-Fe3O4復合材料的BET比表面積、孔體積和平均孔徑分別為174.69 m2·g-1、0.27 cm3·g-1和15.03 nm.根據國際純粹與應用化學聯合會(IUPAC)分類(Ryoo et al., 2001), 該復合物的氮氣吸附脫附等溫線屬于Langmuir Ⅳ型, 為典型的介孔材料吸附曲線, 其孔徑分布曲線屬于H3型, 進一步表明該復合物屬于介孔材料.
圖 3
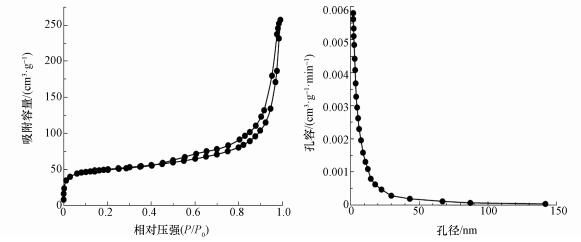
圖 3 CeO2-Fe3O4復合材料的比表面積及孔徑分布 (a.CeO2-Fe3O4的氮氣吸附脫附曲線; b.CeO2-Fe3O4的孔徑分布)
為了探究CeO2-Fe3O4復合材料的磁特性, 室溫下復合材料的磁滯回線如圖 4所示.材料的飽和磁化強度為51.26 emu·g-1, 表明該材料具有弱鐵磁性, 可通過外加磁場進行分離回收.同時通過圖 4的宏觀磁分離內圖可以看出, CeO2-Fe3O4復合材料在溶液中的分散效果較好, 顆粒分布均勻.在外加磁場的作用下, 材料能快速實現固液分離, 這為該材料的回收再利用提供的保障, 也具有更廣泛的應用前景.
圖 4

圖 4 CeO2-Fe3O4復合材料的磁滯曲線
3.2 CeO2-Fe3O4復合材料光催化/吸附除As(Ⅲ)效果研究
在單獨紫外光照射和黑暗條件下僅加入復合材料分別進行對比試驗, 考察不同實驗條件下, 體系中總砷和五價砷濃度隨反應時間的變化, 結果分別如圖 5a和5b所示.僅在紫外光照射下, 體系中總砷濃度沒有發生變化.這說明在紫外照射, 不加入CeO2-Fe3O4復合材料的情況下, As(Ⅲ)不能被有效去除.由于光催化作用僅發生催化劑表面, 因此催化劑具有良好的吸附性能尤為重要.在黑暗條件下, 吸附60 min, CeO2-Fe3O4復合材料對As(Ⅲ)的吸附去除效率約為52.62%, 這說明在短時間內CeO2-Fe3O4對As(Ⅲ)具有較好的吸附效果.盡管As(Ⅲ)可以通過直接吸附作用去除, 但由于吸附劑對As(Ⅲ)的親和力遠低于As(Ⅴ)(Sun et al., 2017), 達到吸附平衡時, As(Ⅲ)的吸附去除效率僅為61.23%.為了進一步提高As(Ⅲ)的去除效果, 在紫外作用下, 體系中加入CeO2-Fe3O4復合材料, 形成UV/ CeO2-Fe3O4體系, 并分別以UV/ Fe3O4、UV/ CeO2體系作對比.在CeO2-Fe3O4光催化作用下, As(Ⅲ)先被氧化為As(Ⅴ), 而后被吸附于CeO2-Fe3O4表面, 該體系中反應4 h, 砷的去除效果可達到98%.這表明在紫外照射下, CeO2-Fe3O4復合材料具有良好的光催化/吸附除砷能力.
圖 5
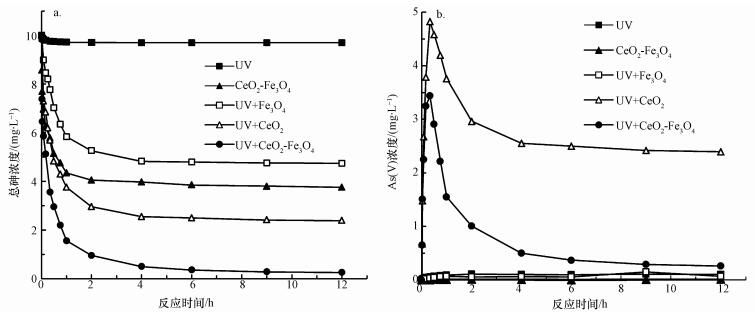
圖 5不同條件下反應時間對總砷(a)和As(Ⅴ)(b)去除效果的影響
由圖 5b可知, 單獨紫外光或CeO2-Fe3O4存在下, 溶液中幾乎檢測不到As(Ⅴ)的存在, 這說明氧氣和紫外輻射不能直接將As(Ⅲ)氧化為As(Ⅴ).此外, UV/ Fe3O4體系中同樣檢測不到As(Ⅴ)的存在, 由于Fe3O4沒有紫外光催化活性, 在紫外光照下, UV/ Fe3O4體系不能將As(Ⅲ)氧化為As(Ⅴ).在CeO2或CeO2-Fe3O4紫外催化作用下, 溶液中As(Ⅴ)的濃度先升高后降低.這是由于As(Ⅴ)的濃度由As(Ⅲ)的氧化和As(Ⅴ)的吸附兩部分決定.As(Ⅲ)氧化為As(Ⅴ)使溶液中As(Ⅴ)的濃度升高, 而As(Ⅴ)吸附于CeO2-Fe3O4表面使溶液中As(Ⅴ)的濃度降低.由此可見, 在反應開始時, As(Ⅲ)的氧化作用占主導地位.從圖 6中可以看出, 反應20 min, 溶液中總砷濃度和As(Ⅴ)的濃度相同, As(Ⅲ)的濃度幾乎為零, 即在CeO2或CeO2-Fe3O4光催化氧化作用下, As(Ⅲ)完全被氧化為低毒的As(Ⅴ), 這說明CeO2和CeO2-Fe3O4材料均具有較好的紫外光催化活性, 進一步證實了CeO2為CeO2-Fe3O4材料中的光催化活性組份.隨后, As(Ⅴ)被吸附于CeO2-Fe3O4表面, 得到最終去除, 體系中的總砷濃度和As(Ⅴ)濃度隨之降低.
圖 6
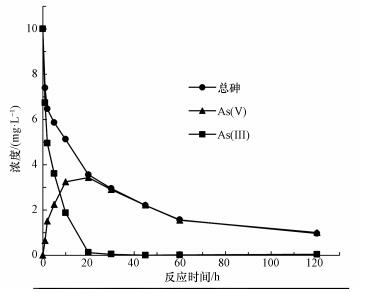
圖 6 CeO2-Fe3O4復合材料光催化/吸附過程中不同種類砷濃度變化
3.3 CeO2-Fe3O4復合材料吸附特性研究3.3.1 吸附動力學
吸附動力學常作為描述吸附速率和吸附動態平衡的指標.從圖 7中可以看出, 整個吸附過程可以分為兩個階段, 第一階段是快速吸附過程, 所需時間較短, 反應2 h吸附容量已達到吸附平衡容量的80%以上.這是由于CeO2-Fe3O4復合材料對砷的吸附主要為孔道擴散吸附, 在最初階段, 固液界面的傳質擴散過程較快.第二階段是吸附平衡過程, 以粒子內擴散為主, 吸附速率下降, 所需時間較長.當砷濃度為10 mg·L-1時, 達到吸附平衡所需時間為4 h.因此, 后續試驗反應接觸時間為12 h, 以確保吸附平衡.
圖 7
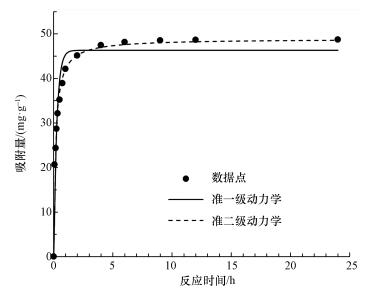
圖 7 CeO2-Fe3O4復合物吸附除砷的吸附動力學模擬
吸附動力學模型在一定程度上能夠解釋吸附機理, 確定吸附速率的控制步驟, 分別用準一級動力學和準二級動力學模型對數據進行動力學擬合, 方程如式(1)和(2)所示.
式中, qe為吸附平衡時的吸附量(mg·g-1);qt為任意時刻的吸附量(mg·g-1);t為反應時間(min);k1為準一級動力學吸附速率常數(min-1);k2為準二級動力學吸附速率常數(g·mg-1·min-1).
動力學非線性擬合結果如表 1所示, 兩種動力學模型對吸附過程的擬合度都達到了0.93以上, 但準二級動力學模型的擬合度更高, 可達到0.99, 這說明吸附過程更符合準二級動力學模型.這表明吸附過程主要由化學吸附為主導, 吸附質和吸附劑之間存在電子轉移過程(Sun et al., 2017).具體聯系污水寶或參見http://www.jianfeilema.cn更多相關技術文檔。
3.3.2 吸附等溫線
吸附等溫線常用于評價吸附劑的吸附能力.本研究選用三價砷的初始濃度范圍為1~50 mg·L-1, 進行光催化/吸附除砷實驗, 并分別采用Langmuir和Freundlich吸附等溫線對數據進行擬合, Langmuir和Freundlich吸附等溫模型方程如式(3)和(4)所示.
式中, ce為吸附平衡時溶液中砷離子的濃度(mg·L-1);qe為吸附平衡時的吸附量(mg·g-1);qm為飽和吸附量(mg·g-1);KL為Langmuir常數;n, KF為Freundlich常數.
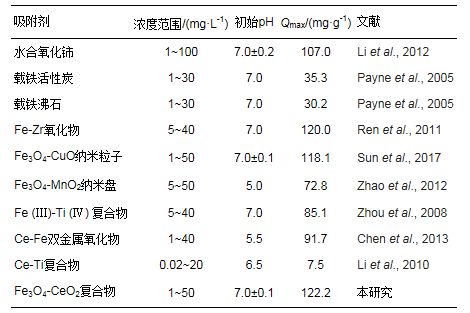
由圖 8可知, 隨著As(Ⅲ)初始濃度的增加, 吸附平衡容量隨之增大.當初始濃度增大到一定程度時, 吸附等溫曲線增長速率緩慢, 吸附趨于飽和.此外, 分別采用Langmuir和Freundlich吸附等溫模型進行非線性擬合, 相關參數如表 2所示.擬合結果表明, Langmuir和Freundlich吸附等溫模型的擬合結果都良好, 擬合度R2都達到了0.95以上.但比較而言, Freundlich模型的擬合度更高(R2= 0.99).這是由于Langmuir吸附等溫模型基于單層吸附理論推導, 而Freundlich吸附等溫模型的理論基礎為多相吸附.在光催化/吸附過程中, 三價砷的吸附過程伴隨著氧化還原反應的發生, 這是一種非均相吸附過程, 所以三價砷的吸附過程更適用于Freundlich吸附等溫模型描述.在Freundlich吸附等溫式中, n是一個與溫度等因素有關的常數, 通常用來評價吸附劑表面吸附點位的不均勻性和吸附結合力的大小, 它的值越大表明吸附劑表面越不均勻, 吸附結合力越大(Shan et al., 2013;Ren et al., 2011).從擬合的結果可以看出n=2.61, 進一步說明CeO2-Fe3O4吸附劑的表面的不均勻性, 吸附結合力比較大, 具有一定的吸附能力.此外由Langmuir吸附等溫模型擬合結果得出, CeO2-Fe3O4納米粒子的吸附飽和量為122.19 mg·g-1, 其明顯高于其他吸附劑的飽和吸附量(表 3).可見, CeO2-Fe3O4納米粒子能夠高效的去除水中的砷污染物, 具有廣闊的應用前景.
圖 8
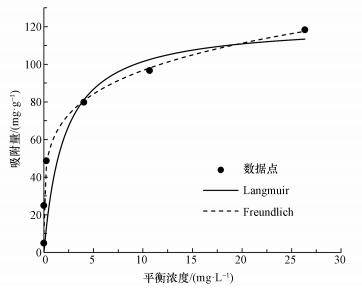
圖 8 CeO2-Fe3O4復合物吸附除砷的吸附等溫線模擬
表 2 砷吸附的吸附等溫線模型參數
表 3 不同吸附劑對砷的最大飽和量比較
3.4 CeO2-Fe3O4復合材料光催化/吸附影響因素3.4.1 初始pH的影響
分別采用0.1 mol·L-1 HNO3和0.1 mol·L-1 NaOH調節初始pH值, 考察初始pH對CeO2-Fe3O4復合物光催化/吸附除砷效果的影響.從圖 9b中可以看出, pH在4~8范圍內, 溶液中砷的去除率保持在98%左右, 這表明在中性或酸性條件下, CeO2-Fe3O4復合粒子對砷具有較高的去除效果.然而, pH在9~12范圍內, 砷的去除率迅速減小至不足35%.有研究人員發現五價砷的吸附受pH的影響較大, 尤其是在pH>7的條件下, 并且隨著pH的增大受影響的程度也越來越大(Zhang et al., 2007).這是因為五價砷在pH < 6.8的時候在水中以H2AsO4-的形式存在, 在更高pH溶液中以HAsO42-的形式存在.當溶液的pH小于吸附劑的等電點的時候, 吸附劑表面的羥基會質子化變成OH2+, 并增強吸附劑表面對五價砷的吸附力.隨著pH的增大, 吸附劑表面逐漸變為帶負電, 這種吸附力也就越來越弱, 導致吸附劑的吸附能力下降.由圖 9a可知, CeO2-Fe3O4納米粒子的等電點為8.5, 所以當pH < 8.5時, 吸附劑表面帶正電荷, 此時五價砷在水中是以H2AsO4-和HAsO42-的形式存在的, 通過靜電引力作用可以提高吸附劑對五價砷的吸附能力, 從而提高了砷的去除率.在堿性條件下(pH>8.5), 吸附劑表面帶負電荷, 而五價砷自身帶有更多的負電荷, 主要由AsO43-的形式存在.由于靜電斥力的作用降低了吸附劑對砷的吸附能力, 導致了砷去除率的降低.
圖 9
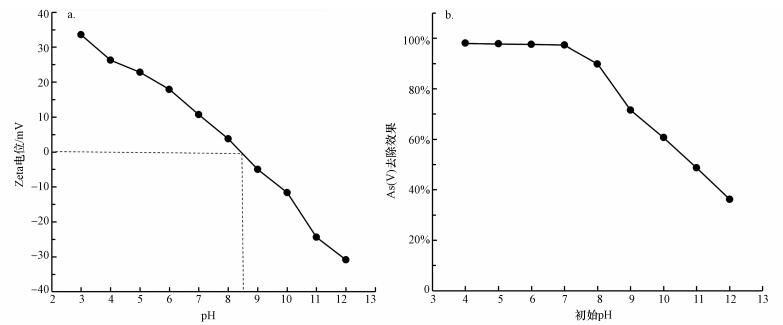
圖 9 Zeta(a)及初始pH對CeO2-Fe3O4復合物光催化/吸附除砷效果的影響(b)
3.4.2 共存離子的影響
在自然水體中, 共存離子和砷酸根之間形成競爭關系, 降低吸附劑對砷的去除能力.因此本研究考察了Cl-、SO42-、CO32-、SiO32-和PO43-5種常見陰離子對砷去除效果的影響, 結果如圖 10所示.Cl-和SO42-的存在對As(Ⅴ)的吸附幾乎沒有影響, 而CO32-、SiO32-和PO43-的存在對砷的吸附有抑制作用, 且隨著競爭離子濃度的增加, 砷的吸附效果顯著降低.通常情況下, Cl-只能和鐵的氧化物或氫氧化物形成外層配合物(Zhang et al., 2007).SO42-和鐵氧化物之間形成內層或外層配合物取決于溶液pH, 在pH>6時, SO42-主要是通過外配位作用吸附到吸附劑表面(Shan et al., 2013).相反地, AsO43-則通過配位體交換的機制與吸附劑之間形成牢固的內層配合物(Zhang et al., 2007).因此, Cl-和SO42-的存在對砷的吸附效果沒有明顯影響.然而, 共存的SiO32-、PO43-和鐵氧化物或氫氧化物之間形成內層配合物(Zhang et al., 2009), 從而與AsO43-競爭吸附點位, 導致砷的去除效果降低.此外, 磷與砷元素屬于同一主族, 化學性質相似, 對砷的競爭能力最強.對于CO32-來說, 即使CO32-和AsO43-均可以與鐵的氧化物或氫氧化物之間產生內配位作用, 形成內層配合物, 但碳酸鹽的親和力要大大低于砷酸鹽, 使其對砷的吸附影響相對較小(Brechbühl et al., 2012).
圖 10
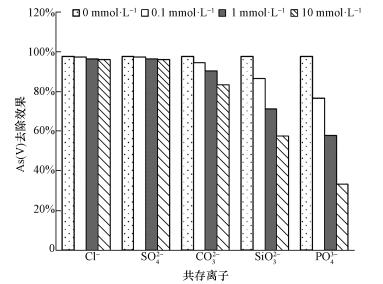
圖 10共存離子對CeO2-Fe3O4復合物光催化/吸附除砷效果的影響
3.5 CeO2-Fe3O4復合材料的重復利用性
經濟簡單的再生方法和良好的重復利用性是吸附材料在實際應用中的關鍵.采用0.5 mol·L-1 NaOH和0.1 mol·L-1 NaCl作為再生劑, 通過循環利用5次復合材料的光催化/吸附、脫附效率變化, 考察CeO2-Fe3O4復合材料的重復利用性.由圖 11可知, 經過每次循環實驗后, 砷的去除效果均有些許下降, 但降低率均在3%之內.循環利用5次后, 光催化/吸附除砷效率仍可達到90%以上, 再生脫附效率可到達84%.可見, 多次循環使用后, 材料經過再生處理仍能保持較好的催化/吸附能力, 這說明CeO2-Fe3O4復合材料具有良好的重復利用性能.
圖 11
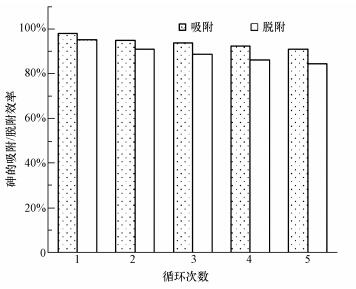
圖 11 CeO2-Fe3O4復合物的重復利用性
3.6 CeO2-Fe3O4復合材料光催化/吸附除As(Ⅲ)的機理研究
為了確定光催化氧化過程中的氧化活性物種, 在UV/ CeO2-Fe3O4體系中加入捕捉劑進行研究, 實驗結果如圖 12所示.分別選取叔丁醇(t-BuOH), 氮氣(N2)和甲酸(FA)作為羥基自由基(·OH)、超氧自由基(· O2-)和光生空穴的捕捉劑.在甲酸存在條件下, As(Ⅲ)的氧化效率沒有明顯降低, 這說明在As(Ⅲ)氧化過程中, 光生空穴不是氧化活性物種.而加入叔丁醇或通入氮氣后, As(Ⅲ)的氧化效率明顯降低, 這說明光生·OH和·O2-是As(Ⅲ)氧化的主要活性物種.
圖
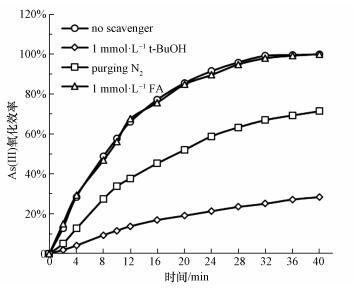
圖 12自由基捕捉劑對As(Ⅲ)氧化效率的影響
CeO2-Fe3O4復合材料光催化/吸附除As(Ⅲ)的機理如圖 13所示.光催化過程產的羥基自由基和超氧自由基在As(Ⅲ)的氧化過程中起重要作用.在紫外光照射下, 體系中的水和溶解氧在CeO2-Fe3O4復合材料的光催化作用下, 分別產生具有強氧化性的·OH和·O2-, 具體反應式見式(5)~(7).
圖 13
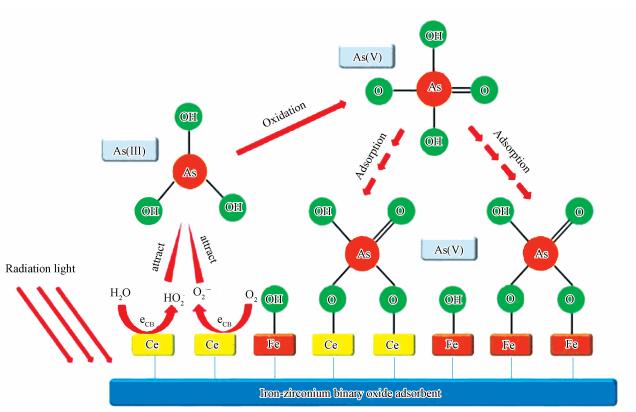
圖 13 CeO2-Fe3O4復合材料光催化/吸附除As(Ⅲ)的機理圖
![]()
由于生成的自由基的壽命很短, 光催化氧化反應多發生在光催化劑表面或附近.基于上述分析, CeO2-Fe3O4復合材料光催化/吸附除As(Ⅲ)的過程主要分為3個階段.首先, 由于CeO2-Fe3O4復合材料對砷具有良好的吸附性能, 水中As(Ⅲ)快速吸附于復合材料表面.緊接著, 吸附于材料表面和附近的As(Ⅲ)被光生自由基氧化為As(Ⅴ).由于光催化氧化過程反應迅速, 在此過程中As(Ⅲ)的氧化速率遠高于As(Ⅴ)的吸附速率.最終, 溶液中的As(Ⅲ)被完全氧化為As(Ⅴ), As(Ⅴ)被吸附于CeO2-Fe3O4復合材料表面得以去除.此光催化/吸附除As(Ⅲ)機理能夠很好的解釋上述實驗結果, 證實了CeO2-Fe3O4復合材料兼具良好的光催化活性和吸附性能.
4 結論(Conclusions)
1) 磁性CeO2-Fe3O4復合物為介孔材料, 比表面積、平均孔徑分別為174.69 m2·g-1和15.03 nm;并具有穩定的弱鐵磁性, 飽和磁化強度為51.26 emu·g-1.
2) 在紫外作用下, As(Ⅲ)能完全被氧化為毒性較低的As(Ⅴ), 同時將As(Ⅴ)高效吸附于CeO2-Fe3O4粒子表面.
3) 在中性條件下, CeO2-Fe3O4粒子對As(Ⅴ)的飽和吸附量為122.19 mg·g-1, 其對As(Ⅴ)的吸附過程以化學吸附為主導.
4) 共存離子Cl-和SO42-對As(Ⅴ)的吸附沒有顯著影響, 而CO32-、SiO32-和PO43-與As(Ⅴ)存在明顯的競爭吸附, 使As(Ⅴ)的吸附去除效果明顯降低.
5) CeO2-Fe3O4復合吸附劑可快速實現固液分離, 容易再生且重復利用性較好, 具有一定的實際應用價值.(來源:環境科學學報 作者:孫天一)