1 引言(Introduction)
生物膜(Biofilm)是由附著于惰性或者活性固體材料表面的微生物和由微生物自身分泌的胞外聚合物(Extracellular polymeric substances, EPS)所形成的高度結構化微生物群落(Costerton et al., 1999).它的存在可引起一系列的環境問題, 如膜污染、管道堵塞、金屬表面腐蝕和消毒效率降低等(Gino et al., 2010; Schwering et al., 2013).目前對其控制多采用殺菌劑、抗菌劑或其它大分子抑菌劑(Rosmaninho et al., 2007; Simões et al., 2010).但這些物質的釋放無疑帶來了新的環境風險, 長期使用抗生素或者殺菌劑還會導致細菌的抗藥性增加, 耐藥細菌蔓延(Davies, 2003).
利用化學信號小分子物質通過抑制微生物活性, 調節生物膜的發展過程是目前生物膜領域的研究熱點.雙(3-氨基丙基)胺是某些微生物自身產生的可以引起一些生物膜解體的信號分子(Qu et al., 2016), 探討這種小分子物質的生物膜調控作用對于開發新興生物膜控制技術具有重要意義.目前, 雙(3-氨基丙基)胺對微生物附著的抑制研究較少且多集中于純菌生物膜, 對混合菌落生物膜的抑制研究鮮有報道.實際環境中的生物膜多由混合菌群組成, 因此有必要研究雙(3-氨基丙基)胺對混合菌落生物膜抑制及解聚效應.本研究將以雙(3-氨基丙基)胺為目標物質, 考察這種小分子物質對混合菌落生物膜形成抑制及解體效應機制, 并進一步對其減緩膜表面生物污染的可行性進行探討.該研究對于建立基于小分子物質的生物膜抑制及膜表面生物污染控制方法具有理論價值與實際指導意義.
2 材料與方法(Materials and methods)2.1 化學試劑和微生物
雙(3-氨基丙基)胺購自美國Sigma-Aldrich公司, 純度為99%.其他化學試劑購于夢怡美生物科技有限公司(北京, 中國).
混合菌落來源于清河污水處理廠(北京, 中國)的活性污泥, 經過上海美吉生物醫藥科技有限公司通過MiSeq系統分析組成主要包括叢毛單胞菌屬(Comamonas)、孢魚菌科(Nakamurella)、腸桿菌科(Enterobacteriaceae)、梭狀芽孢桿菌(Clostridium)、鞘脂單胞菌屬(Sphingomonas)、假單胞菌屬(Pseudomonas)、固氮螺菌屬(Azospira)、寡養單胞菌(Stenotrophomonas)和鐵桿菌屬(Ferribacterium).活性污泥首先用磷酸鹽緩沖溶液(PBS)沖洗3遍以去除污泥溶液中的EPS及有機物, 然后將活性污泥重懸于合成廢水中用于制備混合菌菌懸液(100 mg VSS·L-1)(大約108 CFU·mL-1).合成廢水包含(mg·L-1):COD (以葡萄糖計算) 825;NH4Cl 192;KH2PO4 35.1;NaCl 100;MgSO4 100;CaCl2 10;pH=6.5~7.5.
2.2 雙(3-氨基丙基)胺對混合菌群生物膜形成影響研究
將含有不同濃度雙(3-氨基丙基)胺的菌懸液加入到聚苯乙烯的12孔板中, 每孔4 mL, 雙(3-氨基丙基)胺終濃度分別為0、2.62、6.55、13.10、26.20、65.50或131 mg·L-1, 每個濃度設置6個平行樣以確保實驗的準確性.將加完樣品的12孔板置于30 ℃恒溫培養箱中分別靜止培養12 h和24 h.培養完成后附著的生物膜量利用結晶紫染色法相對定量(Xiong et al., 2013).本研究以活性污泥作為生物膜形成的混合菌來源, 隨著生物膜的形成和發展, 其群落結構可能會與活性污泥有一些差別, 但本研究重點不是關注其群落結構演變過程, 而是以生物膜形式負載到基底材料表面生物量的變化, 并以其來評價生物膜形成抑制效應.
2.3 不同基底層上雙(3-氨基丙基)胺對混合菌群附著影響
抑制劑對微生物附著特性的影響和附著基底材料表面特性密切相關, 所以本研究進一步考察了雙(3-氨基丙基)胺對微生物在不同材質基底層表面的附著影響.分別選擇具有不同親疏水性特性的聚苯乙烯(6孔板)、玻璃片和聚甲基丙烯酸甲酯3種材料為附著界面, 3種表面接觸角分別為93.4°、22.0°和81.9°.分別將20 mm× 20 mm玻璃片或聚甲基丙烯酸甲酯片置于6孔板中進行附著實驗, 每個孔板中加入6 mL污泥懸液, 再分別加入雙(3-氨基丙基)胺終濃度為0或131 mg·L-1.污泥懸液、基質濃度及操作條件和上述的附著實驗一致.培養24 h后, 將載玻片烘干, 染色并用Olympus相機進行拍照記錄.
2.4 雙(3-氨基丙基)胺對膜污染緩解效應研究
將雙(3-氨基丙基)胺投加到溶液通過和懸浮微生物作用之后, 微生物在膜表面的附著實驗分別以靜態附著和動態死端過濾形式考察.靜態實驗如下:將直徑為3.5 cm的膜片置于6孔培養板, 加入10 mL混合菌液, 同時加入雙(3-氨基丙基)胺使其終濃度分別為0或131 mg·L-1, 30 ℃恒溫培養箱中靜止培養24 h, 取出膜片放在15 mL PBS中超聲使附著的微生物完全脫落后在旋渦混合器中快速混合15 s, 測定細菌OD600值(張利平等, 2011)(因結晶紫染料會和膜材料表面結合影響實驗結果, 故采用混合渦旋脫離生物膜后直接測菌體光密度的方法).動態過濾采用恒流過濾模式, 使用一臺蠕動泵將儲水容器中混合菌液(含有或不含有131 mg·L-1的雙(3-氨基丙基)胺)通過管道壓入膜組件(膜直徑4 cm), 電子天平收集溶液的質量數據, 當膜表面造成一定堵塞之后, 膜壓增加, 壓力表讀數上升.通過壓力表讀數可間接評價膜污染發展狀況.
2.5 雙(3-氨基丙基)胺對混合菌群生物膜解體影響研究
為了考察雙(3-氨基丙基)胺對生物膜的解體性能, 需預先培養生物膜(12 h).然后將載玻片拿出洗掉未附著的微生物.然后放置于含有131 mg·L-1雙(3-氨基丙基)胺的PBS溶液中, 另外的載玻片放入只含有PBS的溶液中作為對照, 30 ℃分別靜置6、8、10或12 h后, 將載玻片拿出洗掉懸浮的微生物, 剩余生物量采用如上結晶紫染色法進行相對定量.
2.6 雙(3-氨基丙基)胺對懸浮微生物EPS分布影響研究
為了探討雙(3-氨基丙基)胺對生物膜形成抑制機理, 本研究進一步對懸浮混合菌群微生物的EPS進行考察.具體操作步驟如下:將含有一定濃度的污泥懸液和基質(如上)置于50 mL離心管中, 同時加入雙(3-氨基丙基)胺使其最終濃度分別為0、131 mg·mL-1, 30 ℃放置一定時間, 測定EPS含量變化, 同時測定懸浮液的OD600變化.EPS的提取參考Xuan等(2010)的方法, 蛋白測定采用的Lowry法(Frølund et al., 1996), 多糖的測定采用的是硫酸-苯酚比色法(Dubois et al., 1956);eDNA的測定參考Allesen-Holm等(2006)的方法.
3 結果與討論(Results and discussion)3.1 雙(3-氨基丙基)對混合菌群生物膜形成影響
不同濃度雙(3-氨基丙基)胺對混合菌群微生物附著特性的影響結果如圖 1所示.微生物經2.62~131 mg·L-1雙(3-氨基丙基)胺處理12 h附著量下降了5.61%~67.93%, 處理24 h附著量下降了4.60%~74.61%.可見在選定的兩個時間段對微生物附著的抑制作用均隨著雙(3-氨基丙基)胺濃度升高而增強.
圖 1
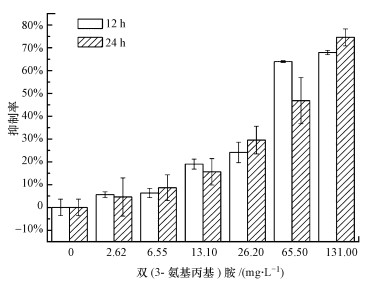
圖 1不同濃度雙(3-氨基丙基)胺對混合菌落生物膜形成影響 3.2 不同基底層上雙(3-氨基丙基)胺對微生物附著影響
微生物附著到載體表面是生物膜形成的第一步, 可以通過特異性或者非特異性的細菌-表面相互作用發生(Hochbaum et al., 2011).一些表面特性會影響微生物的附著, 且一些抑制劑對微生物附著抑制作用也會受到表面特性的影響.因此, 本研究對于不同基底層上雙(3-氨基丙基)胺對微生物附著影響特性進行考察.雙(3-氨基丙基)胺存在的情況下, 附著到基底材料的生物量經結晶紫染色記錄, 如圖 2所示.結果顯示無論是在疏水性的聚苯乙烯表面還是親水性的聚甲基丙烯酸甲酯和玻璃表面, 雙(3-氨基丙基)胺對微生物的附著均有很好地抑制作用.說明這種物質可以廣泛應用于不同材質材料表面生物膜的控制.
圖 2

圖 2不同基底層表面雙(3-氨基丙基)胺對微生物附著影響
3.3 雙(3-氨基丙基)胺對膜污染緩解效應研究
另外, 為了進一步探討雙(3-氨基丙基)胺控制膜表面生物污染的可能性, 將雙(3-氨基丙基)胺投加到溶液通過和懸浮微生物作用之后, 考察微生物在膜表面的附著形態, 分別以靜態附著和動態過濾形式考察.靜態形式培養條件下, 微生物經過不同濃度的雙(3-氨基丙基)胺作用后在聚酰胺膜表面的附著量如圖 3所示.結果顯示, 微生物經過雙(3-氨基丙基)胺處理在膜表面的附著量明顯降低, 而且雙(3-氨基丙基)胺濃度越高, 附著量越少.例如, 經過26.2、65.5及131.0 mg·L-1雙(3-氨基丙基)胺處理后, 微生物在膜表面附著量分別降低了18.38%、31.03%和69.15%.雙(3-氨基丙基)胺顯著抑制了微生物在膜表面的附著, 而且這種抑制效果和雙(3-氨基丙基)胺濃度成正相關.此結果也在SEM中得到證實, 對照組膜表面形成的微生物群落比較致密, 生物膜連成片, 而實驗組膜表面附著的微生物相當稀疏, 有大量的空白區域, 實驗組膜表面附著的生物量要明顯少于對照組膜表面附著的微生物量.
圖 3
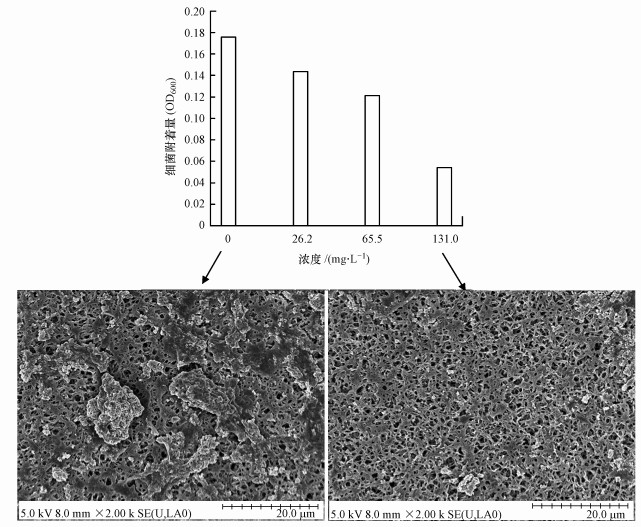
圖 3雙(3-氨基丙基)胺對混合菌落微生物在聚酰胺膜表面的附著影響
對于生物膜動態過濾培養過程, 膜過濾過程中膜壓隨過濾液質量及時間變化如圖 4所示.由圖可以看出, 當過濾重量為359.71 g, 過濾時間170 min時, 對照組膜孔(即過濾液中沒有雙(3-氨基丙基)胺)發生了一定程度的堵塞, 此時膜壓為10 kPa, 但實驗組(即過濾液中加有雙(3-氨基丙基)胺)中的膜壓仍然為0, 表明膜孔徑并沒有像對照組膜堵塞嚴重;當過濾液質量為628.55 g, 過濾時間為300 min時, 實驗組中的膜壓力開始上升, 膜壓為12.5 kPa, 約為過濾時間175 min時的對照組膜壓, 而此時對照組中的膜壓已經為50 kPa.這表明雙(3-氨基丙基)胺可減緩膜過濾過程中膜孔堵塞速度, 降低膜壓, 緩解由微生物引起的膜污染問題.
圖 4
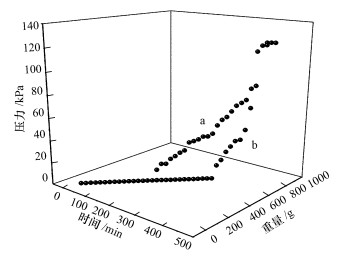
圖 4膜過濾過程膜壓隨過濾質量和過濾時間變化圖 (a.對照組; b.實驗組)
3.4 雙(3-氨基丙基)胺對混合菌群生物膜解體影響
一些傳統的物理化學方法, 如沖刷、消毒劑及紫外線消毒等常被用作生物膜去除, 但由于生物膜中細菌受EPS的保護作用使其對這些常規方法具有一定抗性, 即使高濃度的殺菌劑也很難將生物膜去除.例如, 500 mg·L-1的常規剝離劑也難以剝離成熟的生物膜, 紫外線對生物膜中微生物殺滅能力明顯弱于對懸浮微生物的殺滅作用(王海峰等, 2010).本研究進一步對小分子物質雙(3-氨基丙基)胺能否引起成熟生物膜解體進行探討.131.0 mg·L-1雙(3-氨基丙基)胺對于預培養12 h的生物膜解體效果如圖 5所示.由圖得出, 雙(3-氨基丙基)胺處理生物膜6~12 h后, 生物膜量相對于對照組下降了3.87%~23.59%, 由此可以說明雙(3-氨基丙基)胺對生物膜解體有一定的促進作用.這對于控制生物膜, 降低微生物安全風險具有重要的意義.具體聯系污水寶或參見http://www.jianfeilema.cn更多相關技術文檔。
圖 5
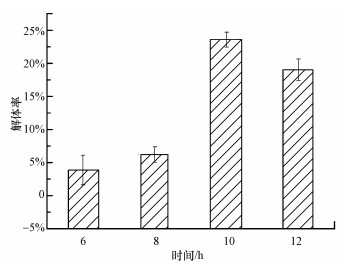
圖 5雙(3-氨基丙基)胺對成熟生物膜的解體作用
3.5 雙(3-氨基丙基)胺對微生物EPS分泌的影響
為了進一步探究雙(3-氨基丙基)胺對微生物的作用機制, 本研究進一步考察了雙(3-氨基丙基)胺對微生物生長及其EPS(胞外蛋白、多糖和DNA)的影響.結果如圖 6所示, 131 mg·L-1雙(3-氨基丙基)胺對微生物12 h生長量的抑制率為0.36%±0.54%, 沒有抑制微生物生長;對照組中胞外蛋白、多糖和eDNA的含量分別是(8.48±0.46) mg·g-1 MLVSS、(3.04±0.20) mg·g-1 MLVSS和(18.33±2.55) μg·g-1 MLVSS, 經過雙(3-氨基丙基)胺處理之后, 胞外多糖和eDNA均有下降, 分別為(1.85±0.08) mg·g-1 MLVSS, (5.49±0.54) μg·g-1 MLVSS, 下降了39.37%±2.68%和70.05%±2.93%, 而胞外蛋白含量幾乎沒有變化, 均保持在8.02~8.98 mg·g-1 MLVSS.本課題組進一步通過激光共聚焦觀察及定量計算顯示雙(3-氨基丙基)胺對生物膜處理后使多糖減少了53%(Wu et al., 2016).由此可以推斷雙(3-氨基丙基)胺對微生物附著及生物膜形成的抑制作用并不是通過殺菌產生, 對微生物EPS中胞外多糖和eDNA分泌有一定的抑制作用, 但對胞外蛋白沒有影響.
圖 6
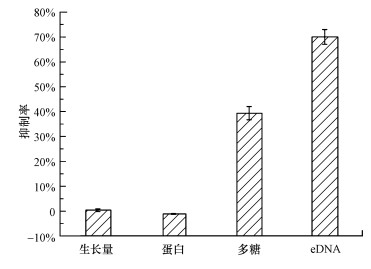
圖 6雙(3-氨基丙基)胺對微生物生長及EPS產量的影響
據報道, 雙(3-氨基丙基)胺結構中含有的氨基可以直接和一些帶負電荷的基團或者是胞外多糖中一些帶有極性基團的糖類相互作用(Kropec et al., 2005; Sutherland, 2001), 這可能是其引起二者濃度降低的重要原因.眾所周知, EPS(蛋白、多糖和eDNA)對于微生物附著及其生物膜形成起著至關重要的作用, 它促使微生物在生物和非生物表面的初始附著.將EPS完全去除以后, 微生物的附著性能顯著降低.胞外多糖是生物膜形成的誘導因子, 可使表面預處理化附著更容易發生, 甚至可以作為細菌碳源(Beauregard et al., 2013);eDNA對于微生物在親水性和疏水性表面的附著都起著重要的作用(Das et al., 2010), 它通過多種方式調控生物膜的發展過程, 如為其他細菌提供基質、它是生物膜結構的重要成分、可促進基因物質的交換(Wu et al., 2009)及調控結合性攝取系統等(Petersen et al., 2005).另外, EPS中的蛋白組大多為帶正電荷的疏水性物質、多糖為帶負電荷的親水性物質及eDNA為帶負電荷的疏水性物質(Sheng et al., 2010), 三者之間的相互作用維持了細菌的表面特性, 當這三者組成發生變化時會造成細菌表面特性的變化, 而細菌表面特性(親疏水性和表面電荷)和微生物的附著密切相關(Harimawan et al., 2011).所以本研究中雙(3-氨基丙基)胺通過抑制微生物中EPS某些成分的特性或者分泌, 進而影響微生物附著和生物膜形成, 并且導致一小部分的生物膜可以從EPS的包裹中釋放出來解體為懸浮態細菌, 即引起生物膜解體.已有一些報道也發現當EPS中蛋白、多糖和eDNA濃度降低時, 微生物附著量相應下降(Lv et al., 2014; Xu et al., 2011).
4 結論(Conclusions)
1) 雙(3-氨基丙基)胺能有效抑制混合菌群微生物附著和生物膜形成, 隨著濃度的升高抑制作用增強, 且其抑制效果較為穩定, 抑制率不會隨著時間延長而降低.
2) 雙(3-氨基丙基)胺對成熟生物膜解體有一定的促進作用.這對于控制生物膜, 降低微生物安全風險具有重要的意義.
3) 雙(3-氨基丙基)胺在生物膜形成有效抑制濃度(26.2~131.0 mg·L-1)范圍內并沒有對于微生物生長產生顯著作用, 因此不是通過殺菌方式抑制生物膜形成, 而是通過抑制微生物中EPS含量, 可以避免傳統殺菌劑產生的抗藥性問題, 因此為生物膜抑制提供了新方法.
4) 雙(3-氨基丙基)胺可減緩膜過濾過程中膜孔堵塞速度, 降低膜壓, 緩解由微生物引起的膜污染問題, 這對環境中膜污染控制具有潛在的指導意義.(來源:環境科學學報 作者:司秀榮)


