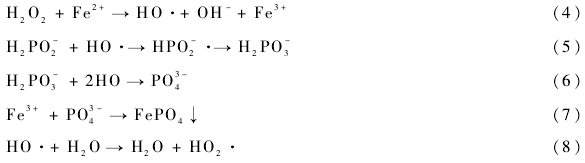化學鍍鎳是以鎳鹽和次磷酸鹽等共同作用生成的非晶鍍層,是一種前沿的表面處理技術,被廣泛的用于電子、石油、計算機和汽車等領域。以次磷酸鹽為還原劑的化學鍍鎳技術的機理是原子氫理論,該理論認為是H2PO2-催化脫氫產生原子氫并還原鎳離子,其總反應式如式(1)所示:
隨著化學鍍時間的不斷延長,溶液中的亞硫酸根離子等副產物達到一定濃度時,化學鍍溶液會自發分解,金屬一磷合金鍍層的沉積受到影響,鍍層的耐磨性等性能下降,導致廢棄,形成化學鍍廢液。化學鍍鎳廢液中含有大量難降解有機污染物和無機鹽,其中的金屬鎳含量高達幾克每升,鎳離子與絡合劑EDTA,NTA等結合形成穩定的高濃度難降解工業廢液,很難通過傳統的化學破絡及沉淀方法徹底去除。同時,化學鍍鎳廢液中含有含量較高的次磷酸根和亞磷酸根離子,不加處理會引起水體富營養化。目前,化學鍍鎳廢水主要采用化學沉淀法、離子交換法、膜分離及吸附法進行處理。但離子交換法,膜分離及吸附法存在運行操作技術要求高,膜易受污染以及離子交換劑飽和再生等限制,不能大范圍的推廣應用。化學破絡及沉淀法操作方便、設備簡單,在含鎳廢水中應用較多。如施銀燕等采用雙氧水和NaOH沉淀去除廢水中的鎳離子,于泊集等使用氫氧化鎂處理不同pH值得含鎳廢水均取得一定的去除效果。李蛟等用CaO破絡合劑處理鍍鎳廢水,結果表明鎳離子的最高去除率只有32%,因此,單一的化學試劑處理并無法滿足廢水中金屬離子、無機鹽和有機物的同時去除。《污水綜合排放標準》(CB 8978-1996)中明確限定磷酸鹽的排放限值應低于0. 5 mg / L ,而化學鍍廢水中次/亞磷酸鹽由于溶度積較高,直接投加Ca和Fe離子對其沉淀效果較差,必須將其氧化為正磷酸根再通過沉淀等手段去除。Fenton ( H2 O2 +Fe2+)氧化技術是高級氧化技術的一種,其產生輕基自由基(HO·)氧化電位高達2. 8 eV,可以氧化絕大多數的有機或無機物,具有試劑無毒、綠色、操作簡單等特點。因此,通過Fenton氧化技術不僅可以去除化學鍍廢水中的高濃度有機物,還可以氧化次/亞磷酸鹽,回收反應過程中正磷酸根和三價鐵形成的高純度磷酸鐵,從而實現資源回收。
本文在化學沉淀的基礎上,采用兩段式處理工藝,即CaO破絡除鎳和Fenton氧化法去除有機物和磷,對反應過程中的各影響因索進行了研究。研究表明,該方法不僅能有效的去除廢水中的金屬鎳,更可以回收反應過程中產生的磷酸鐵。該工藝處理效率高,操作簡單,實用性強,將具有一定的應用價值。
1 實驗部分
1.1 實驗水樣
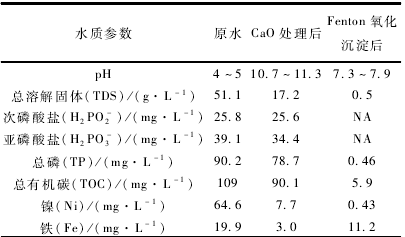
實驗所用廢水取自某化學鍍鎳車間,廢水產量約1 t / d,呈淺綠色,該化學鍍廢水中主要包含硫酸鎳、次磷酸氫鈉、檸檬酸鈉、乙酸和氨水等。該廢水性質如表1所示。
表1 某化學鍍鎳廢水及處理后水質指標
1. 2實驗方法
取化學鍍鎳廢水250 mL于錐形瓶中,迅速加入一定量的CaO粉末并置于控溫搖床(25℃)上按一定速率攪拌反應1h,于4 000 r / min離心分離并測定上清液中的鎳離子濃度。取破絡沉淀后廢液于250 mL錐形瓶中并置于磁力攪拌器上,調節pH值并加入一定量的FeSO4 ·7H2O,待藥劑溶解后加入一定量H2O2溶液進行反應,每隔20 min取樣并調節樣品pH至10一11,過濾后測定樣品上清液中次/亞磷酸根和總磷濃度。
1. 3主要儀器及試劑
FE20-FiveEasy PlusTM pH計(梅特勒一托利多公司);DKY-II恒溫調速回轉式搖床;DF-101 S集熱式恒溫磁力攪拌器;TAS-990原子吸收分光光度計(普析通用);NexION 300X電感禍合等離子體質譜儀(PerkinElmer ) ; Nicolet iS10傅立葉變換紅外光譜儀(Thermo Scientific ) ; multi N/C 3100總有機碳分析儀;D/max-2550VB/PC X射線粉末多晶衍射儀。實驗過程所用藥品氧化鈣(CaO )、硫酸(HRSO4)、氫氧化鈉(NaOH )、過氧化氫(H2O2 ) ( 30% )、硫酸亞鐵(FeSO4 · 7H2O)等試劑均為分析純,由國藥集團化學試劑有限公司提供。
1. 4分析與測試方法
金屬離子采用電感禍合等離子質譜儀進行測定;次磷酸鹽、亞磷酸鹽按照硫代硫酸鈉滴定法測定;磷酸鐵晶體形貌采用X射線衍射儀(XRD)進行測定;其他常規項目依據《水和廢水監測分析方法》(第4版)進行測定。
2結果與討論
2. 1破絡沉淀對鎳去除效率的影響
2.1.1 CaO投加量對鎳去除效率的影響
分別取250 mL廢液于7個錐形瓶中并加入0. 4 ,0. 8 ,1.4,1.8,2,4和6 g / L的CaO粉末,粉末粒徑為150-200 μm,置于25℃恒溫搖床上振蕩,反應1h后取上清液測定鎳離子含量,結果如圖1所示。由圖1可知,隨著CaO投加量的增加,廢水中剩余鎳濃度逐漸降低,吸附去除率逐漸上升。當CaO投加量從0. 4 g / L增加到1. 8 g / L時,Ni 2+去除率從50%上升到82%,表明CaO可以有效破解廢水中的絡合鎳。廢水中的乙酸會以單體吸附的方式附著于Ni基體上形成單嚙絡合物,該絡合物穩定性較低。溶解于水中的鈣離子可與廢液中的乙酸絡合物相互作用而使鎳離子脫除配位基變為Ni 2+。隨著CaO投加量的繼續增加,溶液pH不斷上升,Ni 2+與OH-相互作用并形成沉淀,從而使鎳離子的去除率不斷增加。當CaO用量大于2 g / L時,鎳離子去除率的變化并不明顯,其最高去除率達到84 %,這與李蛟等的研究結論相一致。同時,鈣離子可沉淀廢水中的部分亞磷酸根離子,當投加2 g / L時,亞磷酸根可去除12. 0%。
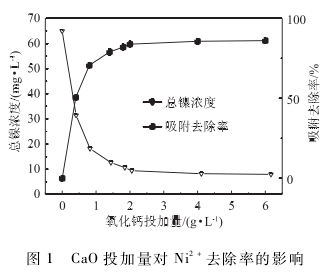
2. 1. 2反應時間對鎳去除效率的影響
取250 mL水樣于錐形瓶中,加入2 g / L的CaO粉末置于25℃恒溫搖床上震蕩,分別反應5、10、20 、40 、60 、80和100 min,取樣、離心后測定剩余鎳離子含量,實驗結果如圖2(a)所示。隨著反應時間的延長,廢水中剩余Nit‘濃度逐漸降低,反應60 min時,剩余Ni 2+濃度達到7. 72 mg / L,氧化鈣吸附量達到15. 57 mg / g 。同時對反應結果按準一級和準二級反應動力學方程(方程式(2)和(3))進行擬合,結果如圖2(b)一(c)所示。
其中準一級反應動力學方程:
準二級反應動力學方程:
式中:qe和qt,分別表示達到平衡時刻和t時刻被去除的鎳的量;k1和k2為去除速率。
從圖2 (b)-(c)擬合曲線可以看出,準二級反應動力學的擬合結果要優于準一級反應動力學。準二級動力學模型擬合的相關系數R為0. 999,得到的qe為15. 53 mg / g ,該值更接近真實實驗數值,說明CaO參與了Ni 2+離子的化學去除反應過程,此過程涉及到鈣離子與破絡后鎳離子之間化學鍵的形成。
對比吸附前后CaO粉末的XRD衍射圖譜可知,圖3(a)中代表CaO特征吸收峰的2θ為32. 1°、 37. 3°和53. 9°的峰強度逐漸減弱,同時2θ位于33. 8°和47. 0°均出現了氫氧化鈣的特征衍射峰,證實了CaO破絡去除廢液中鎳離子的溶解反應過程。而2θ位于39. 0°和43. 2°處則分別出現了Ni2O3和NiO的特征衍射峰,證明CaO的加入促進了后期鎳離子與OH-形成沉淀。同時,圖3 (b)中吸附后的CaO粉末在850cm -1出現了明顯的Ni-O伸縮振動吸收峰、在1160 cm -1處出現了Ca-O-Ca的伸縮振動峰以及1470 cm -1處出現了C-H的烷基特征振動峰。同時,3 400 cm -1出現O-H伸縮振動,以上均說明CaO溶解于水樣后,與單嚙絡合物作用,使水中配位鎳離子脫掉配位基,形成鎳離子。Ni 2+與OH-形成Ni(OH)2沉淀,與XRD分析結果一致。
在最佳條件下(即CaO投加量2 g / L,反應時間1 h)處理后的廢水性質如表1所示。由表1可知,經CaO破絡沉淀預處理后的廢液中鎳離子含量大幅降低,可達到7.7 mg / L,但仍無法滿足國家污水綜合排放標準設定的1mg / L的要求,同時廢液中以亞磷酸鹽為代表的總磷含量超標嚴重,因此,考慮對預處理后廢液進行Fenton催化氧化,使亞磷酸鹽轉化為正磷酸鹽的同時可與體系中的三價鐵形成磷酸鐵沉淀,從而達到資源回收利用的目的。

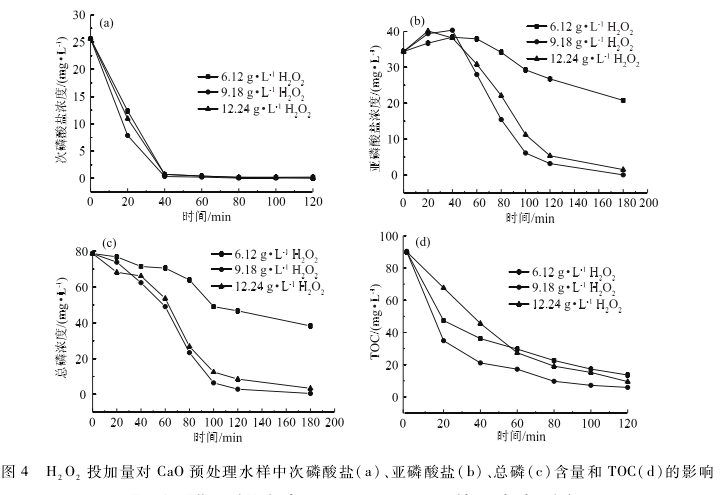
2.2 Fenton催化氧化對廢液中磷處理效果的影響
2. 2. 1 H2O2投加量對次磷、亞磷和總磷轉化效果的影響
取CaO破絡后的水樣150 mL于錐形瓶中并置于磁力攪拌器上,調節pH為4,依預實驗結果按m(H2O2 )/m( Fe2+)為5:1加入FeSO4·7H2O,待溶解后加入6. 12 、9. 18和12. 24 mg / L過氧化氫溶液進行反應,反應過程中取10 mL樣品,調節pH為10,待沉淀離心后進行測試。溶液中次磷酸、亞磷酸、總磷酸含量和TOC隨反應時間的變化情況如圖4所示。
由圖4可知,不同氧化劑投加量下,次磷酸鹽在反應40 min后的轉化率接近100 %,而亞磷酸鹽濃度則在反應前40 min時小幅增加后迅速降低,總磷濃度和TOC則逐漸降低。反應180 min后投加6. 12、9. 18和12. 24mg / L的總磷濃度分別降低至38. 25 、0. 46和3. 35 mg / L ,TOC分別降至13.6 、5. 9和9. 5 mg / L。Fenton反應生成的強自由基HO·可以有效氧化體系中的次磷酸鹽、亞磷酸鹽和有機物。首先,H2O2分解后產生的強氧化性輕基自由基(式(4))可迅速被溶液中H2PO2-捕捉并生成H2PO3-,其三者轉化率均大于99%,剩余的HO·進一步與H2PO3-反應生成正磷酸鹽(式(5)和(6))。反應后期,由原催化劑Fe2+轉化生成的Fe3+與PO4 3-結合(式(7 ) ),可進一步轉變為磷酸鐵沉淀,而磷酸鐵是一種涂料添加劑,被廣泛用作陶瓷和鏗電池原材料,因而實現資源的回收利用。
同時,觀察H2O2投加量對三者濃度的變化影響可知,過少或過多的氧化劑均不利于體系中次磷酸鹽、亞磷酸鹽和正磷的轉化。投加量過高雖提高了前期反應速率卻影響體系的最終轉化率,這可能與單位時間內過高濃度的H2O2與大量生成的輕基自由基發生的副反應有關(見式(8)。
2.2.2反應初始pH對次磷、亞磷和TOC轉化效果的影響
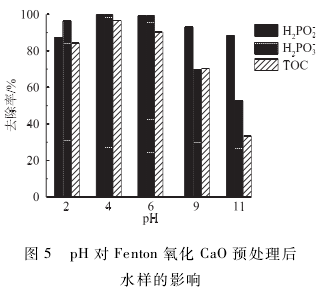
取CaO破絡后的水樣150 mL于錐形瓶中置于磁力攪拌器上,分別調節水樣pH為2、4、6、9和11,依預實驗結果按m ( H2O2 ) / m ( Fe2+)為5:1(質量比)加入FeSO4·7HzO,待溶解后加入6. 12 g / LH2O2反應180 min,反應結果如圖5所示。在初始pH條件為酸性時,次磷酸根和亞磷酸根均可被有效氧化,這與劉鵬的實驗結果相一致。但當初始pH值繼續增加,次/亞磷酸根轉化為正磷酸根的效率有所降低,這是由于當pH值過高時(>11),H2O2會分解為H2PO2-從而降低體系中自由基的氧化能力,同時H2O2在較高pH范圍內易發生自分解反應并生成大量O2從而降低體系的氧化效率。水樣TOC去除率隨pH的變化規律與亞磷酸鹽類似,呈現隨pH增高而降低的趨勢,當pH為11時TOC去除率最低為33.2%,因此,本實驗合理的pH范圍應該為4 -5之間。
2.2.3 Fenton氧化后沉淀物性質分析
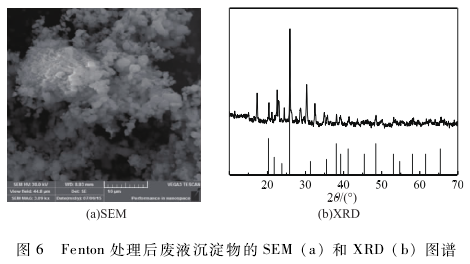
最佳條件下(反應初始pH為4,[H2O2]為9. 18 mg / L;m(H2O2)/m(Fe2+)為5:1;反應時間為180min ) Fenton氧化CaO預處理廢液的水質參數如表1所示,可以看到,兩段式工藝處理后的廢水其各項指標均符合《污水綜合排放標準》(CB 8978-1996 )。將回收的Fenton反應沉淀物經水洗、干燥和600℃馬弗爐焙燒后,其微觀形貌和X射線晶體衍射特征吸收峰如圖6所示。由圖6可知,回收的沉淀物成球形、團聚狀,粒徑介于0. 5一1 μm之間,而其XRD衍射峰位置和強度與磷酸鐵標準圖譜PDF50-1635相吻合,說明磷酸鐵的純度較高,可以應用于陶瓷或磷酸鐵鏗等行業。這說明Fenton氧化反應過程中的三價鐵和正磷酸根能夠聚合沉淀形成高純度的磷酸鐵而被回收利用,能夠取得良好的環境效益和經濟效益,具有實際應用價值。具體參見污水寶商城資料或http://www.jianfeilema.cn更多相關技術文檔。
3結論
1)CaO預處理含鎳廢水時,在CaO投加量為2 g / L、反應時間為1h的最佳條件下,鎳離子和亞磷酸鹽的去除率可分別達到82%和12.0%,達到預處理的預期目的。
2)采用Fenton氧化預去除預處理后水樣中有機物及次/亞磷酸鹽效果較好。控制反應初始pH =4,H2O2投加量為9. 18 mg / L、m(H2O2)/m(Fe2+ ) =5: 1、反應時l司為180 min,Ni2+ ,TP和TOC濃度可分別降至0. 43 ,0. 46和5. 9 mg / L,出水水質達到污水綜合排放標準。
3)破絡一Fenton法處理化學鍍鎳廢液后產生的高純度磷酸鐵可直接回收,實現了資源化的處理目的。

 (3)
(3)