鈾是一種具有放射性和高毒性的重金屬元素,對生態環境和人體健康存在極大威脅. 在核工業生產(如核電站)的各個環節及核事故中,均會產生一定量的含鈾放射性廢水[1]. 因此,需要對含鈾放射性廢水進行妥善處理與處置.
傳統的放射性廢水處理技術大多采用物理法或物理化學法. 用于處理低、 中放射性廢水的技術主要包括化學沉淀、 蒸發、 離子交換和膜分離(低放廢水)等[2]. 雖然傳統的放射性廢水處理技術在大部分情況下對放射性核素的去除效率較高,并且技術發展較為成熟,但仍存在處理低濃度廢水時效率較低[3]、 藥劑消耗大(化學沉淀)、 能耗高(蒸發)、 易腐蝕與結垢(蒸發)、 易產生二次污染[4]等局限性.
除上述傳統技術外,吸附技術因操作簡單和處理效率高等優點,在放射性廢水處理領域研究較多[5],尤其生物吸附技術更是引起了廣泛關注[6, 7, 8]. 許多微生物如細菌、 放線菌、 真菌和微藻等,均可作為生物吸附劑[9, 10, 11, 12, 13, 14]. 其中,利用微藻作為吸附劑具有獨特的技術優勢:易于培養,可利用太陽光將CO2直接轉化為生物質,甚至可以在經過預處理的生活污水中生長[15, 16]; 藻細胞易于分離收獲; 能耗低; 無二次污染,環境生態友好; 有可能對有價值的重金屬進行回收[6, 17, 18, 19, 20]. 因此,利用微藻作為生物吸附劑處理含鈾放射性廢水,已成為近年來放射性廢水處理領域的研究熱點.
獲得吸附鈾的優勢藻種是研究和應用微藻生物吸附技術的前提和基礎. 從實際工程應用的角度出發,優勢藻種的篩選原則應綜合考慮多種因素.
(1)吸附容量大 單位藻細胞生物質對鈾元素的吸附量盡可能大,從而減少微藻吸附劑的投加量,同時提高含鈾放射性廢水的處理效率.
(2)培養成本低 微藻培養的成本較高,限制了其在污水處理和生物能源生產等領域的工程化應用. 微藻生長對水和氮磷無機鹽的大量消耗是造成其高培養成本的首要因素[21]. 若藻種能在生活污水一級、 二級處理出水中生長,則可充分利用其中的水和氮磷資源,從而降低培養成本.
(3)生物質產量高 藻種可在生活污水二級處理出水等低氮磷水體中生長,且生物質產量高.
(4)沉降性能好 藻種在培養進入穩定期后,藻細胞沉降速率快,以利于分離收獲.
本研究以上述篩選原則為基礎,選擇了11株備選藻種進行吸附鈾的優勢藻種篩選工作,以期為后續研究提供材料基礎.
1 材料與方法
1.1 材料
1.1.1 藻種
備選藻種共計11株,包括8株實驗室分離藻種和3株購買藻種.
在8株實驗室分離藻種中,柵藻LX1(Scenedesmus sp. LX1)由長期儲存的自來水中分離獲得; 小球藻ZTY1(Chlorella sp. ZTY1)、 小球藻ZTY2(Chlorella sp. ZTY2)、 斜生柵藻ZTY(Scenedesmus obliquus ZTY)和橢圓柵藻ZTY(Scenedesmus ovalternus ZTY)由城鎮生活污水一級出水中分離獲得; 柵藻ZSF1(Scenedesmus sp. ZSF1)、 柵藻ZSF2(Scenedesmus sp. ZSF2)和羊角月牙藻ZSF(Selenastrum sp. ZSF)由以再生水為補充水源的景觀水體(北京高碑店湖)中分離獲得. 由上述8株藻種的分離環境可以看出,本研究旨在獲得1株既對鈾有良好的吸附性能、 又可在低氮磷水體(以城鎮生活污水處理出水為代表)中生長的優勢藻種,以降低工程化應用時的藻細胞培養成本.
其余3株藻種均購自中國科學院水生生物研究所淡水藻種庫.
11株備選藻種的具體情況如表 1所示.

表 1 11株備選藻種
1.1.2 藻細胞培養基
采用低氮磷水平的mBG11培養基,模擬城鎮污水處理廠污染物排放一級A標準的氮磷濃度限值(TN為15 mg ·L-1,TP為1.5 mg ·L-1). 成分組成為:NaNO3 91.1 mg ·L-1、 K2HPO4 ·3H2O 11 mg ·L-1,其余組分同稀釋50%的BG11培養基,包括MgSO4 ·7H2O 37.5 mg ·L-1、 CaCl2 ·2H2O 18 mg ·L-1、 檸檬酸3 mg ·L-1、 檸檬酸亞鐵銨3 mg ·L-1、 EDTA(乙二胺四乙酸)0.5 mg ·L-1、 Na2CO3 10 mg ·L-1、 A5+Co溶液1.0 mL ·L-1. A5+Co溶液的組成為:H3BO3 2.86 g ·L-1、 MnCl2 ·4H2O 1.81 g ·L-1、 ZnSO4 ·7H2O 222 mg ·L-1、 CuSO4 ·5H2O 79 mg ·L-1、 Na2MoO4 ·2H2O 390 mg ·L-1、 Co(NO3)2 ·6H2O 49 mg ·L-1.
1.1.3 主要儀器設備
人工光照培養箱(HPG-280H)、 高溫滅菌鍋(SANYO MLS-3750)、 離心機(HITACHI CF 16RXⅡ)、 超凈工作臺(AIRTECH VS-1300L-U)、 恒溫水浴鍋(ANPEL DC-12H)、 精密電子分析天平(島津AUY220)、 冷凍干燥機(FDU-1100)、 pH計(Sartorius PB-10)、 雙功能水浴恒溫振蕩器(SHA-B)、 紫外可見分光光度計(UV-2401PC).
1.2 方法
1.2.1 藻細胞培養
向500 mL錐形瓶中加入200 mL mBG11培養基,高溫高壓滅菌(121℃,30 min,除特別指出,所有水樣在微藻培養前均經過高溫高壓滅菌處理),取5 mL藻種液接種至上述培養基中,放入光照培養箱中培養.
培養條件:光照強度56 μmol ·(m2 ·s)-1,光暗比14 h ∶10 h,溫度25℃.
1.2.2 藻種分離
藻種分離的方法為平板劃線法.
向50 mL mBG11液體培養基中接種藻種,培養3-4 d后,將藻種液分別稀釋1、 2、 5、 10和20倍,然后劃線涂在mBG11固體培養基(瓊脂含量2.5%)平板上,再置于光照培養箱中培養,培養條件同1.2.1節.
待固體平板上長出單個藻落后,挑取單個藻落再次進行劃線分離和培養. 反復3次后得到純藻種.
1.2.3 藻細胞干重測定
將孔徑為0.45 μm的濾膜浸泡在高純水中并煮沸,重復3次以除去濾膜中的雜質. 將煮后的濾膜在105℃烘箱中烘干24 h,在干燥器中晾至室溫后用千分之一天平稱取其重量. 取適量藻液用上述濾膜過濾,將截留藻細胞的濾膜在105℃烘箱中烘干24 h,在干燥器中晾至室溫后用千分之一天平稱取其重量. 前后兩次測得的濾膜質量差即為藻細胞干重.
1.2.4 藻細胞沉降性測定
待藻細胞生長進入穩定期后,測量藻細胞干重. 在室溫下取200 mL搖勻藻液,置于Imhoff沉降管中靜置沉降60 min,將上清液(180 mL)倒出,利用濾膜法測量底部20 mL濃藻液的藻細胞干重,再根據式(1)計算沉降率S.
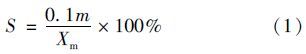
式中,S:表征藻液中可沉降部分占總生物質的比例,%; Xm:原藻液的藻干重,g ·L-1; m:Imhoff沉降管底部20 mL濃縮藻液的藻干重,g ·L-1.
沉降率S的值越大,表明藻細胞的沉降性越好.
1.2.5 溶液中 U(Ⅵ)含量的測定
溶液中 U(Ⅵ)含量的測定采用5-Br-PADAP分光光度法,具體測定步驟如下.
(1)配制試劑
① 混合掩蔽劑溶液:稱取12 g環己二胺四乙酸(CyDTA),溶于150 g ·L-1的氫氧化鈉溶液,加入3 g氟化鈉、 32 g磺基水楊酸和400 mL水. 待全部溶解后,調節溶液 pH 至8,然后加水稀釋至500 mL. ② 酚酞指示劑:0.1 g ·L-1乙醇溶液. ③ 三乙醇胺緩沖溶液:取100 mL三乙醇胺溶于300 mL水中,調節溶液pH至8,再加水稀釋至500 mL,混勻. ④ 丙酮:純丙酮試劑. ⑤ 顯色劑Br-PADAP乙醇溶液:稱取0.25 g Br-PADAP溶于500 mL無水乙醇溶液.
(2)繪制標準曲線
取6個50 mL容量瓶,分別加入含有0、 10、 20、 30、 40、 50 μg鈾的標準溶液[硝酸雙氧鈾,UO2(NO3)2 ·6H2O]; 加入5 mL混合掩蔽劑溶液和1滴酚酞指示劑; 先用400 g ·L-1的氫氧化鈉溶液調至粉紅色,再用1 mol ·L-1的鹽酸調至無色; 加入3 mL三乙醇胺緩沖溶液、 10 mL丙酮和3 mL顯色劑Br-PADAP乙醇溶液; 用水稀釋至刻度,搖勻. 放置30-60 min后,以空白溶液為參比,測定鈾標準溶液在580 nm下的吸光度值D580,并建立D580與鈾質量(μg)關系的標準曲線,如圖 1所示.
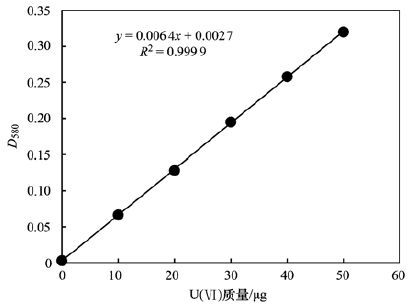
圖 1 鈾標準溶液在580 nm下的吸光度D580和U(Ⅵ)質量的關系曲線
1.2.6 藻細胞對鈾的吸附容量測定[22]
待藻細胞在mBG11培養基中生長進入穩定期后,對藻細胞進行離心收獲、 冷凍干燥、 研磨,制成藻干粉.
用移液管量取50 mL已知質量濃度的鈾溶液至100 mL帶塞錐形瓶中,用 0.1 mol ·L-1的鹽酸和NaOH溶液調節pH值至4,加入一定量的藻粉,置于30℃水浴恒溫振蕩器中振蕩60 min. 吸附過程結束后,取一定量混合液離心(10 000 r ·min-1,10 min,4℃),取上清液用5-Br-PADAP分光光度法測定其吸光度D580,并根據吸光度D580和U(Ⅵ)質量的關系曲線計算上清液中的鈾離子含量. 藻細胞對鈾離子的吸附容量qt (mg ·g-1)可通過式(2)計算:

式中,qt:藻細胞對鈾離子的吸附容量,mg ·g-1; c0:鈾溶液的初始濃度,mg ·L-1; ct:上清液中的鈾濃度,mg ·L-1; V:鈾溶液的體積,L; m:加入藻粉的質量,g.
1.2.7 試驗數據處理
每組試驗均做3個平行樣,并對試驗數據進行誤差分析.
2 結果與分析
2.1 不同藻種對鈾的吸附容量比較
藻細胞對鈾的吸附容量是篩選優勢藻種需要考慮的首要因素. 分別取11株備選藻種的25 mg藻干粉加入50 mL初始鈾濃度為50 mg ·L-1的鈾溶液中,在30℃水浴恒溫下振蕩60 min后,不同藻種對鈾的吸附容量對比如圖 2所示. 從中可見,在11株備選藻種中,柵藻LX1對鈾的吸附容量最大,為40.7 mg ·g-1,其次是普通小球藻.
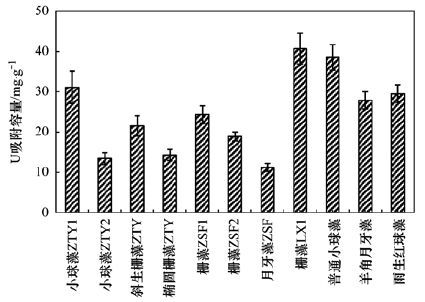
圖 2 不同藻種對鈾的吸附容量對比
2.2 不同藻種在mBG11培養基中的最大生物量比較
11株備選藻種在mBG11培養基中生長16 d、 進入穩定期后的最大生物量對比如圖 3所示,可代表藻種在城鎮生活污水二級處理出水中的最大生長潛力. 除月牙藻ZSF的最大生物量較低(僅0.16 g ·L-1)外,其余所有藻種的最大生物量均在0.27 g ·L-1以上,尤其是柵藻ZSF1、 小球藻ZTY2、 柵藻LX1等8株藻種的最大生物量達到了0.30-0.40 g ·L-1之間.
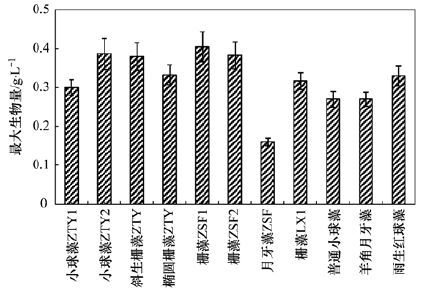
圖 3 不同藻種在mBG11培養基中生長16 d后的最大生物量對比
在一般的微藻培養體系中,典型的藻細胞生物量水平[23]為0.30-0.40 g ·L-1. 可見,除月牙藻ZSF外,絕大部分藻種均在城鎮生活污水二級處理出水中有較大的生長潛力. 其原因為,從污水處理廠或實際水體中分離得到的藻種,往往能夠更好地適應實際水體環境,生長狀況更好[24].
2.3 不同藻種的沉降性能比較
沉降率S表征了藻液靜置60 min后,易于自然沉降的藻細胞生物質占總生物質的比例. 重力沉降是最簡單、 最常用的藻細胞收獲方式之一,沉降率S越高,表明藻細胞越易于通過重力沉降收獲. 11株備選藻種生長進入穩定期后的沉降率對比如圖 4所示.
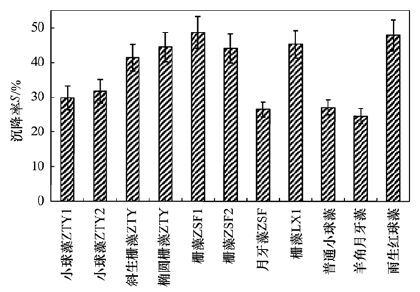
圖 4 不同藻種生長進入穩定期后的沉降率對比
可見,雨生紅球藻和所有柵藻的沉降率普遍較高,均在40.0%以上; 其中,柵藻ZSF1、 雨生紅球藻和柵藻LX1的沉降率較高,分別為48.7%、 47.9%和45.3%. 小球藻的沉降率相對較低,均在30.0%左右. 羊角月牙藻的沉降率最低,僅為24.6%.
3 討論
3.1 藻細胞對鈾的吸附容量
Kalin等[25]總結了不同藻種對U(Ⅵ)的吸附能力,如表 2所示. 其中,Pseudomonas對鈾的吸附容量最大,為96 000 mg ·g-1; 吸附容量在100-600 mg ·g-1之間的藻種有13株,占總數的56.5%; 吸附容量在100 mg ·g-1以下的藻種有9株,占總數的39.1%. 柵藻LX1對鈾的吸附容量在表 2中屬于后40%,與表中柵藻的吸附容量(75 mg ·g-1)同屬一個數量級.
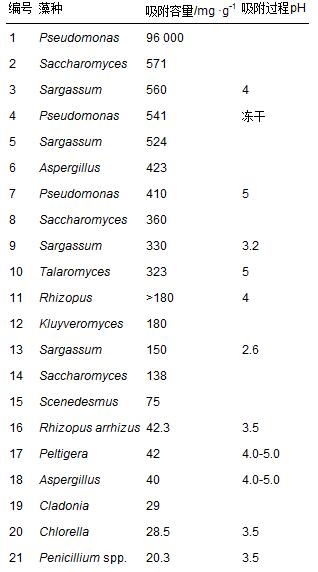

表 2 藻種對U(Ⅵ)的吸附容量對比 [25]
雖然柵藻LX1對鈾的吸附容量與已有報道的藻種相比并不具有優勢,但如前文的篩選原則所述,面向實際應用,不能僅關注吸附容量,還應綜合考慮藻細胞培養成本、 藻細胞易培養性、 藻細胞沉降性能等多種因素.
3.2 吸附鈾的優勢藻種確定
藻種對鈾的吸附容量及其在低氮磷水體(城鎮生活污水處理廠二級處理出水)中的生長潛力,是藻種篩選的兩項主要指標. 以不同藻種在mBG11培養基中的最大生物量為橫坐標、 對鈾的吸附容量為縱坐標,繪制優勢藻種篩選圖,如圖 5所示.
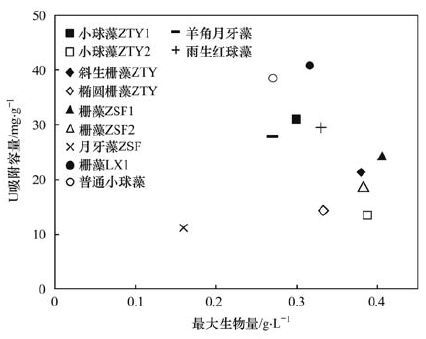
圖 5 吸附鈾的優勢藻種篩選對比
越靠近上方的點,表明藻種對鈾的吸附容量越高; 越靠近右方的點,表明藻種在低氮磷水體中的生長潛力越大. 根據篩選原則,應選擇右上方的點作為優勢藻種.
通過圖 5可以看出,柵藻LX1處于圖中的右上方位置:其對鈾的吸附容量最高,并且在低氮磷水體中的生長潛力也較大. 同時,柵藻LX1在生長進入穩定期后的沉降性能也較好. 因此,在本研究范圍內,可確定柵藻LX1為放射性廢水處理中吸附鈾的優勢藻種.具體參見污水寶商城資料或http://www.jianfeilema.cn更多相關技術文檔。
4 結論
(1)優勢藻種應具備對鈾的吸附容量大、 培養成本低(可在生活污水二級處理出水中生長)、 在低氮磷水體中的生物質產量高、 沉降性能好等特點.
(2)柵藻LX1對鈾的吸附容量最大,為40.7 mg ·g-1.
(3)柵藻LX1在mBG11培養基(模擬城鎮污水處理廠污染物排放一級A標準的氮磷濃度限值:TN 15 mg ·L-1,TP 1.5 mg ·L-1)中的生物質產量較高,為0.32 g ·L-1.
(4)柵藻LX1在生長進入穩定期后的沉降性能較好,沉降率為45.3%.
(5)綜合考慮各項篩選原則,在本研究范圍內,柵藻LX1為放射性廢水處理中吸附鈾的優勢藻種.


