總鐵含量是工業循環冷卻水、鍋爐水和補充水的重要控制指標,可以監控設備腐蝕的情況。當水中鐵質量濃度超過0.5 mg/L時,會促使鐵細菌繁殖,產生的黏泥不僅會堵塞管路,還會加速腐蝕,形成滲漏,損失物料,污染水體,直接危害生產安全。《工業循環冷卻水處理設計規范》(GB 50050—2007)和《工業鍋爐水質》(GB/T 1576—2008)等標準中均規定了需對總鐵含量進行分析監測。
常見微量或痕量鐵的測定方法有原子吸收光譜法[1]、磺基水楊酸光度法[2]、鄰菲羅啉光度法[3]、二甲酚橙光度法[4]等。原子吸收法儀器及附件較復雜,不適用于一般企業實驗室。而正常運行的系統中鐵含量普遍較低,現有的分光光度法靈敏度不夠,或易受水中常見鋅離子的干擾。如二甲酚橙光度法不僅用于測定鐵,還常用于測定血清[5]、葡萄糖酸鋅[6]、人發[7]中的Zn2+,表明鋅的干擾非常嚴重。磺基水楊酸光度法和鄰菲羅啉光度法雖然選擇性較好,但實際檢出限或定量限均較高,靈敏度不佳。筆者以鄰苯二酚紫(以下簡稱PV)為顯色劑,與Fe2+反應生成的藍色絡合物在605 nm處有最大吸收,用紫脲酸銨掩蔽Zn2+,并以預先用鄰菲羅啉掩蔽了鐵的顯色體系作參比,使該波長下的吸光度與Fe2+濃度呈良好的線性關系,相同濃度下的吸光度約是鄰菲羅啉法的5倍。測定了多份工業用水中的總鐵含量,靈敏度、選擇性、準確度和重現性均令人滿意。
1 實驗部分
1.1 儀器與試劑
722S型分光光度計,上海棱光技術有限公司;pHS-25型pH計,上海磁盛機電科技有限公司;U-3310紫外可見分光光度計,日本日立公司。
用NH4Fe(SO4)2·12H2O配制的1 000 mg/L和10 mg/L的Fe3+標準溶液;用(NH4)2Fe(SO4)2·6H2O配制的1 000 mg/L和10 mg/L的Fe2+標準溶液;1.344×10-3 mol/L PV;7.65×10-3 mol/L紫脲酸銨溶液;0.02 mol/L抗壞血酸溶液(以下簡稱AA);0.1 mol/L硼砂-0.4 mol/L NaOH緩沖溶液(pH分別為12.60、10.50),0.1 mol/L硼砂-0.4 mol/L硼酸緩沖溶液(pH分別為9.00、8.00);10 g/L鄰菲羅啉溶液;用ZnSO4·7H2O 配制的1 000 mg/L的Zn2+標準溶液;用KH2PO4配制的1 000 mg/L的PO43-標準溶液;1+3 HCl;濃硝酸;0.2 mol/L NaOH溶液。以上試劑均為分析純,所用水為超純水。
1.2 標準曲線的繪制
分別移取10 mg/L的Fe2+標準溶液0、0.10、0.25、0.50、1.00、2.00、3.00 mL于7只50 mL容量瓶中,依次加入2.00 mL AA溶液、10.00 mL紫脲酸銨溶液、4.00 mL PV溶液及10.00 mL pH=9.00的硼砂-硼酸緩沖溶液,用水定容,得Fe2+質量濃度分別為0、0.020、0.050、0.100、0.200、0.400、0.600 mg/L的標準溶液。室溫下放置12 min,用試劑空白作參比于605 nm處測量其吸光度。以Fe2+濃度為橫坐標,吸光度A為縱坐標繪制標準曲線。
1.3 水樣的分析方法
取水樣100 mL,加入0.5 mL 1+3 HCl溶液,6滴濃HNO3,加熱濃縮至約30 mL,冷卻后定量轉移至50 mL容量瓶定容。分別移取10.00 mL上述處理過的水樣于2只50 mL容量瓶中。其中一只中依次加入2.00 mL AA溶液、5.00 mL 鄰菲羅啉溶液、10.00 mL 紫脲酸銨溶液、4.00 mL PV溶液、1.50 mL NaOH溶液及10.00 mL pH=9.00的硼砂-硼酸緩沖溶液,定容,以此作為參比溶液。另一只容量瓶中除不加入鄰菲羅啉溶液外其余試劑和操作相同,以此作為樣品溶液。室溫下放置12 min,于605 nm處測量樣品溶液的吸光度。根據標準曲線得出水樣中總鐵的含量。
2 結果與討論
2.1 總鐵待測形態的選擇
鄰苯二酚紫與Fe2+和Fe3+均能形成藍色絡合物,由于磷酸鹽(包括正磷、聚磷和有機磷)通常作為緩蝕阻垢劑被投加到循環水或鍋爐水中[8]。因此,考察了磷酸根含量對Fe2+和Fe3+作為標準溶液測定總鐵含量的影響。實驗表明,極少量PO43-的存在即可使Fe3+與PV的顯色反應吸光度大幅降低,而質量濃度高達20 mg/L的PO43-對Fe2+的測定基本無影響。因而選擇Fe2+作為總鐵的待測形態。
2.2 Zn2+的掩蔽
鋅鹽是一種陰極性緩蝕劑,常與其他緩蝕劑聯用,Zn2+在工業循環冷卻水中的質量濃度一般在1~2 mg/L。實驗表明,對于0.1 mg/L Fe2+標準溶液,若要求吸光度測量值的相對偏差不超過±5%,則1倍量的Zn2+即干擾測定。因此,必須選擇合適的Zn2+掩蔽劑以消除其對總鐵測定的影響。紫脲酸銨能與Zn2+形成穩定的絡合物,最大吸收波長455 nm[9]。同時試驗表明,紫脲酸銨基本不與Fe2+絡合,而它與Zn2+形成的絡合物在605 nm處幾乎沒有吸收,說明紫脲酸銨能夠較好地掩蔽Zn2+而不干擾Fe2+的測定。
2.3 參比溶液的確定
雖然紫脲酸銨不與Fe2+反應,但與水中常見的Ca2+有絡合,導致樣品的空白與標準曲線的空白不一致,從而影響樣品中總鐵的準確測定。筆者用以鄰菲羅啉掩蔽鐵后的顯色溶液作參比,可有效避免因空白溶液選擇不當所帶來的測定誤差。即取一定量的樣品溶液,依次加入2.00 mL AA溶液、5.00 mL 鄰菲羅啉溶液、10.00 mL 紫脲酸銨溶液、4.00 mL PV溶液、1.50 mL NaOH溶液及10.00 mL pH=9.00的硼砂-硼酸緩沖溶液,定容,以該溶液作為吸光度測量的參比。這樣,除待測的總鐵外,參比溶液和樣品溶液兩者保持了高度的一致性,所得吸光度可以很好地反映總鐵含量的變化。
2.4 測量條件的選擇
2.4.1 介質pH的選擇
用鄰苯二酚紫法測定鐵時,顯色體系的pH以10.5和12.6為好[10, 11]。而Fe2+在強堿性條件下易形成Fe(OH)2沉淀,因此在不影響鄰苯二酚紫與Fe2+正常顯色的前提下宜適當降低緩沖溶液的pH。按1.2分別試驗了pH為12.60、10.50的硼砂-NaOH緩沖溶液及pH為9.00、8.00的硼砂-硼酸緩沖液對顯色反應的影響,結果見圖1。

圖1 緩沖溶液pH對顯色反應的影響
圖1結果表明,緩沖溶液的pH在上述范圍內對吸光度沒有顯著影響,故選擇pH=9.00的硼砂-硼酸緩沖液。
2.4.2 顯色劑用量的確定
用選定的pH=9.00的硼砂-硼酸緩沖溶液,按1.2分別試驗加入5.00、4.00、2.50 mL PV溶液對顯色反應的影響,結果見圖2。結果表明,4.00 mL PV溶液能夠保證顯色反應正常進行。
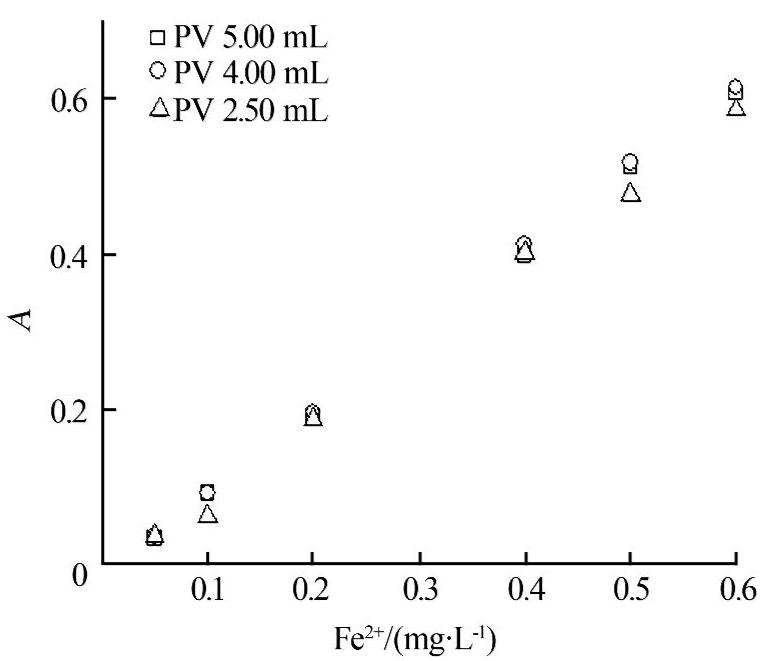
圖2 顯色劑用量對顯色反應的影響
2.4.3 顯色時間的確定
在2.4.1及2.4.2選定的實驗條件下,按照1.2試驗顯色反應時間對顯色反應的影響,結果見圖3。
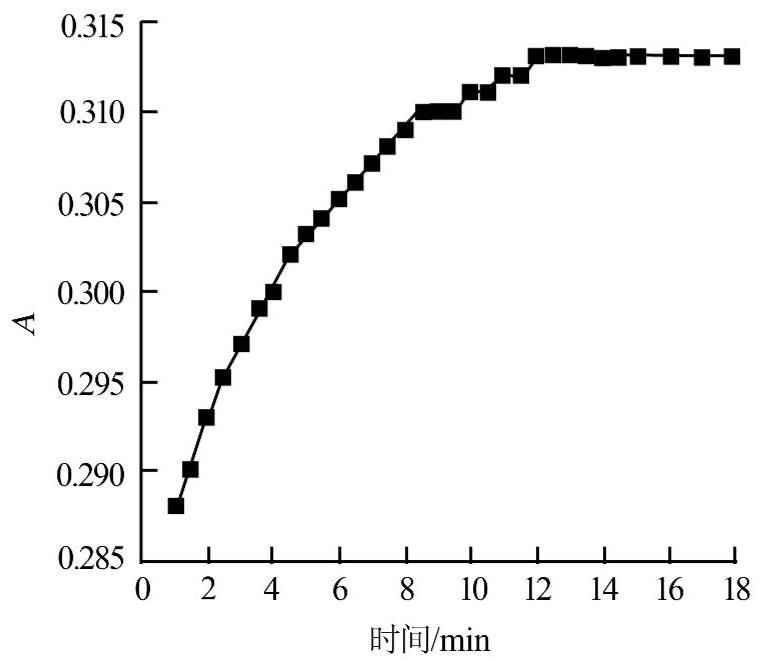
圖3 顯色時間對顯色反應的影響
由圖3可知,12 min后,Fe2+-PV絡合物吸光度趨于穩定,絡合反應進行完全,故選定顯色反應時間為12 min。
2.5 線性范圍及檢出限
按1.2繪制標準曲線,見圖4。
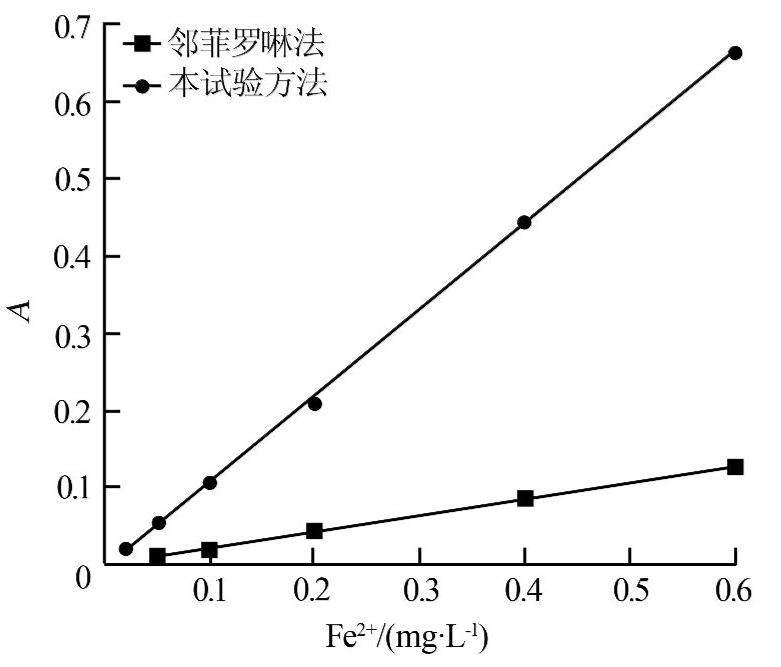
圖4 測定Fe2+的標準曲線
結果表明,本試驗中Fe2+質量濃度在0.02~0.6 mg/L范圍內符合朗伯比爾定律,吸光度約為相同濃度下鄰菲羅啉法的5倍。工作曲線的線性方程A = 1.110c-0.004,線性相關系數r2=0.999,檢出限0.012 mg/L。
2.6 共存組分的影響
用0.1 mg/L Fe2+標準溶液做干擾試驗,要求吸光度的相對偏差不超過±5%,共存物質及允許含量為:5 000倍的SO42-、CO32-、Cl-;2 000倍的Ca2+;500倍的K+、Na+、Al3+;200倍PO43-;100倍的NO3-、Mg2+;50倍的Zn2+;30倍的F-;5倍的Pb2+、Mn2+;2倍的Cu2+。可以滿足循環水、鍋爐水等常見工業用水的測定要求。
2.7 加標回收率和精密度試驗
將按照1.3預處理過的3份取自南京某幾個工廠的工業鍋爐水樣分別平行測定3次,其平均總鐵質量濃度在0.211~0.311 mg/L,加標回收率97.0%~100.0%。選取水樣3平行測定11次,相對標準偏差1.16%。表明本法具有較好的準確度和重現性。具體參見http://www.jianfeilema.cn更多相關技術文檔。
3 結論
用紫脲酸銨掩蔽投加水處理劑后水中常見的鋅離子,在弱堿性條件下用鄰苯二酚紫與Fe2+反應生成藍色絡合物,并以預先用鄰菲羅啉掩蔽了鐵的顯色體系做參比,在605 nm處的吸光度與0.02~0.6 mg/L濃度范圍內的Fe2+呈良好的線性關系。該法簡便易行,具有良好的準確度和重現性,靈敏度約是鄰菲羅啉法(GB/T 14427—2008)的5倍,特別適用于總鐵含量較低且含鋅的工業用水中總鐵的準確測定。


