摘要:含鋅廢水對人體健康和環境具有嚴重的危害性。處理高濃度的含鋅廢水時需先進行化學沉降,然后再進行深度處理。試驗結果證明,對于含289mg/LZn2+的電鍍廢水,用質量分數為10%的氫氧化鈉處理,其投加量為3.7mL/100mL,處理后的Zn2+的濃度為6.6mg/L。再用沸石進行吸附,沸石用量為0.25g/L,攪拌(110r/min)50min,處理后,廢水的鋅離子去除率最高可達88.8%,剩余Zn2+濃度為0.47mg/L,遠低于《國家污水綜合排放標準》(GB8978-2002)的一級標準。
關鍵詞:化學沉降;沸石;吸附;高濃度含鋅廢水
前言
鋅是人體健康不可缺少的元素,它廣泛存在于人體肌肉及骨骼中,但是含量甚微,如果超量就會發生嚴重后果。含鋅廢水對人體健康和環境有嚴重危害,具有持久性、毒性大、污染嚴重等特點,一旦進入環境后不能被生物降解,大多數參與食物鏈循環,并最終在生物體內積累,破壞生物體正常生理代謝活動,危害人體健康。隨著人類對重金屬的開采、冶煉、加工等生產活動的日益增加,產生的重金屬廢水無論是從數量上還是種類上都大大增加,造成了嚴重的環境污染和資源浪費。因此含鋅廢水的治理仍然是世界環保領域的重大研究課題。目前已開發應用的含鋅廢水處理方法主要有3種,即化學法、物理化學法和生物法。
但上述方法都存在一定的局限性。如中和沉淀法處理后,若廢水pH過高,需要中和處理后才可排放。同時可能多種重金屬共存,當廢水中含有Zn、Pb、Sn、Al等兩性金屬時,pH值偏高,有再溶解的傾向,因此要嚴格控制pH值,實行分段沉淀。同時,一般含鋅廢水在多數情況下含有配合劑,配合劑的存在將阻礙氫氧化鋅沉淀的形成,所以采用中和沉淀法處理含鋅廢水很難達到排放標準。硫化沉淀法中,若加入過量的硫,不僅帶來硫的二次污染,而且過量的硫與某些重金屬離子會生成溶于水的絡合離子而降低處理效果。鐵氧化法在形成鐵氧體過程中需要加熱(約70℃),能耗較高,處理后鹽度高,而且有不能處理含Hg和絡合物廢水的缺點。
文中研究利用化學沉降和沸石吸附組合的方法處理高濃度電鍍含鋅廢水,不僅避免了中和沉淀法種種弊端,而且利用天然沸石而無需改性處理就可達到較好的處理效果。本研究先用化學法沉降大部分Zn2+,以Zn(OH)2沉淀的形式除去,可煅燒生成ZnO,從而制成Zn(NO3)2或ZnCl2等試劑,有較高的回收利用價值。然后采用沸石進行吸附處理,使其達到排放標準。從而實現廢物的資源化,具有較好的推廣應用前景。
1·材料與方法
1.1 試驗所用儀器設備
AB204-N型電子天平、JJ-4型六聯電動攪拌器、THZ-82型恒溫振蕩器、SHZ-D型循環水式真空泵、722N型分光光度計。
1.2 試驗所用試劑
氨水、鹽酸、水乙酸、人造沸石、無水乙酸鈉、雙硫腙。
1.3 廢水水質
本試驗所用的廢水來自黃石電鍍有限公司,選用的是生產車間的廢水,Zn2+的含量很高,其水質見表1。
|
|
1.4 試驗方法
將高濃度的含Zn2+廢水先進行化學沉淀,再將沉淀處理后的廢水用沸石吸附,過濾,取上清液進行分析。
1.5 分析方法
用雙硫腙分光光度法測定Zn2+的含量。其測定原理是:在pH為4.0~5.5的乙酸鹽緩沖介質中,Zn2+與雙硫腙形成紅色螯合物,該螯合物可被四氯化碳定量萃取,以混色法完成測定。鋅-雙硫腙螯合物的最大吸收波長為535nm。用此方法測定Zn2+的濃度,以吸光度為縱坐標,以Zn2+的濃度為橫坐標做標準曲線,擬合得曲線方程為y=0.442x+0.0014(式中y是吸光度,x是Zn2+的濃度,單位為mg/L)。
2·結果與討論
2.1 溶液pH值對化學沉降處理效果的影響
分別取100mL原水放于9個250mL燒杯中,依次加入質量分數為10%的氫氧化鈉溶液,調節溶液pH值分別為7.0、8.0、8.4、9.0、9.5、10.0、10.4、12.5,攪拌均勻,靜置,取上清液分析測定廢水中Zn2+的剩余濃度,將沉淀抽濾測其SS,分析試驗結果。向原水中加入氫氧化鈉溶液,Zn2+將以Zn(OH)2的形式沉降,但是當加入過量氫氧化鈉溶液,Zn(OH)2將轉化為ZnO2-2再次溶解,而分光光度法無法測出ZnO2-2中的鋅含量,所以應該找到Zn(OH)2與氫氧化鈉反應生成Na2ZnO2的臨界pH值。試驗結果表明,當溶液pH值為8.4左右時,溶液中Zn2+濃度迅速下降,而懸浮固體SS并未減少,說明此時Zn2+已經大部分沉淀,并有反應生成Na2ZnO2的趨勢,所以8.4左右即為臨界pH值。加入適當氫氧化鈉溶液使原水pH值調至8.4左右,待沉淀完全,靜止分層,取上層清液為后面吸附處理的試驗用水,測定其pH=8.4,含Zn2+濃度為6.6mg/L。用Zn(OH)2的溶度積作對比計算,理論上,當溶液含Zn2+濃度為6.6mg/L時,溶液的pH值為7.6,與試驗結果略有差別,但相差不大,以試驗結果為準。
2.2 吸附時間對吸附效果的影響
取六份100mL經化學沉降處理后的廢水于六個250mL燒杯中,再加入質量濃度為0.2g/L的沸石,分別攪拌10、20、30、40、50、60min,靜置,取上層清液分析,試驗結果見圖1。
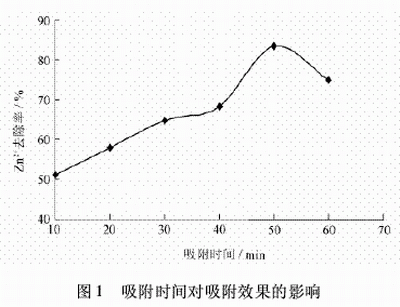 |
從圖1可以看出,隨著吸附時間的增加,Zn2+的去除率逐漸增大,吸附時間為50min時吸附效果最好,Zn2+的去除率達到83.5%,Zn2+的剩余濃度為1.29mg/L。吸附時間過短,反應不充分,處理效果不佳;吸附時間過長,出現解吸速率大于吸附的現象。后續試驗吸附時間為50min。
2.3 吸附劑用量對吸附效果的影響
取六份100mL經化學沉降后的廢水于六個250mL燒杯中,再分別加入質量濃度為0.05、0.1、0.15、0.2、0.25、0.3g/L的沸石,攪拌50min,然后靜置,取上清液分析,試驗結果見圖2。
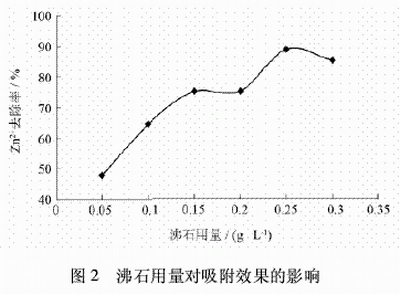 |
從圖2可以看出,隨著沸石用量的增加,Zn2+的去除率逐漸增大,沸石用量為0.25g/L時吸附效果最好。當吸附飽和后吸附效果明顯下降,去除率減小。后續試驗吸附劑用量為0.25g/L。
2.4 pH值對吸附效果的影響
取100mL經化學沉降后的廢水于六個250mL燒杯中,調節pH分別為5.5、6.8、7.5、8.5、9.5、10.5,再分別加入質量濃度為0.25g/L的沸石,攪拌50min,靜置,取上清液分析,試驗結果見圖3。
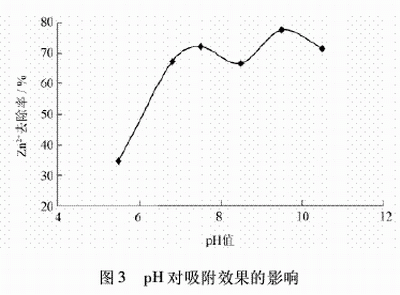 |
從圖3可以看出,隨著pH的增大,Zn2+的去除率增大,pH為9.5時吸附效果最好。pH對吸附質在溶液中存在的形態(電離,絡合)和溶解度均有影響,因而對吸附效果有影響。pH為9.5時吸附效果最好,在實際操作中,還需要考慮處理后水的排放標準(pH為6~9),因此,后續試驗選擇pH為8~9。
2.5 溫度對吸附效果的影響
取100mL經化學沉降后的廢水于六個250mL的燒杯中,調節pH為8.9,再分別加入質量濃度為0.25g/L的沸石,在溫度分別為15、20、25、30、35、40℃的條件下攪拌50min,然后靜置,取上清液分析,試驗結果見圖4。
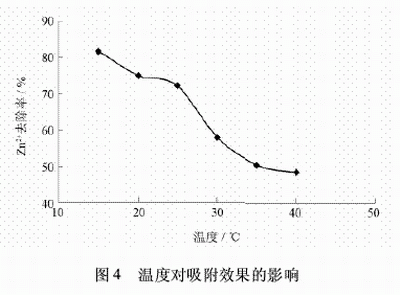 |
從圖4可以看出,隨著溫度的增加,吸附效果有所下降。吸附反應為放熱反應,溫度升高會使反應平衡向著吸熱反應的方向進行。因此,隨著溫度的增加,吸附效果有所下降。實際操作中一般選擇室溫。
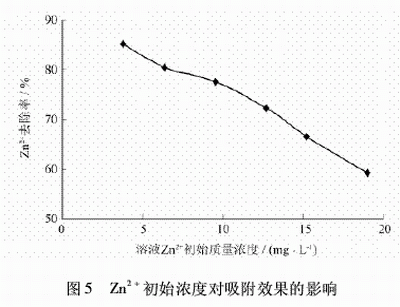
2.6 廢水初始Zn2+濃度對吸附效果的影響
配制初始Zn2+濃度分別為3.81、6.35、9.53、12.7、15.24、19.05mg/L的廢水,各取100mL廢水于6個250mL燒杯中,再分別加入質量濃度為0.25g/L的沸石,攪拌50min,取上清液分析,試驗結果見圖5。
|
|
從圖5可以看出,隨著Zn2+濃度的增加,吸附效果有所下降。因為原水中Zn2+濃度很大,而沸石的吸附容量有限,使得出水不能達到排放標準。同時也說明了高濃度的含鋅廢水不能直接用吸附法處理,而需要先進行化學沉降再進行吸附處理。具體參見http://www.jianfeilema.cn更多相關技術文檔。
3·結論
(1)采用化學沉降和沸石吸附組合工藝處理高濃度含Zn廢水,避免了化學沉降法的弊端,同時利用豐富廉價的沸石礦物資源作為吸附材料,提高了處理效果,達到排放標準。
(2)沸石對水相中鋅離子具有良好的吸附性能,廢水pH值是影響處理效果最重要的因素,隨著pH逐漸增加,鋅離子的去除率不斷增大。當pH為9.5時鋅離子去除率最高,考慮到出水pH值應該在6~9之間,所以將pH值調至6~9為宜。
(3)溫度對處理效果有一定的影響,考慮運行成本,采用室溫即可。
(4)對于100mL經化學沉降處理后的廢水,沸石的最佳吸附時間為50min,吸附劑的最佳用量為2.5g/100mL。
(5)Zn2+的去除率隨著廢水Zn2+初始質量濃度的增加而呈下降趨勢。高濃度的含鋅廢水需要先加入質量百分比為10%的氫氧化鈉進行化學沉降,投加量為3.7mL/100mL,處理后的Zn2+的濃度為6.6mg/L。
(6)經化學沉降預處理后廢水中鋅離子的去除率最高可達88.8%,剩余濃度為0.47mg/L,遠低于國家污水綜合排放標準(GB8978-2002)的一級標準。(谷騰水網)