偏二甲肼(UDMH)是一種性能良好的液體火箭推進劑。隨著航天技術的迅猛發展,UDMH使用量持續增多,在試驗過程中會產生大量的有毒廢水。現階段對UDMH廢水的處理方法包括化學、物理、生物方法等。常用化學方法主要采用氧化工藝,存在處理效率不高、某些中間產物毒性大、易產生二次污染等缺點。常用物理方法主要采用離子交換樹脂、凹凸棒土、活性炭等對廢水中污染物進行分離、轉移,存在處理不徹底、投資成本較高、吸附劑再生困難、吸附效果不佳等缺點。常用生物方法采用細菌、水生植物等降解UDMH廢水,存在易受降解環境影響、降解速率較慢、運行控制較難等問題。一些新型的處理工藝包括超臨界水氧化法、酸性氧化電位水處理技術、低溫等離子體處理技術等。其中超臨界水氧化法可將難降解的大分子有機物在短時間內氧化為N2、H2O、CO2等小分子無毒物質,用結構簡單且體積較小的反應裝置即能達到氧化去除有機物的目的,但缺點是存在條件極其嚴苛,且前期的裝置價格昂貴,不能作為常規降解UD-MH的工藝;酸性氧化電位水處理技術反應速度快,尤其便于快速處理較低濃度、少量的UDMH廢水,但仍需與其他廢水處理技術結合起來,以最大限度提高UDMH廢水處理效果;低溫等離子體處理技術降解較為徹底、效果較佳,但對設備要求較高。因此,如何使用更環保且安全高效的工藝處理UDMH廢水有著極其重要的意義。
在微波輻射下,活性炭吸收微波能量并在其表面形成很多“熱點”,該“熱點”處的能量及溫度比其他地方高出許多,通常被用于誘導反應的催化劑。目前,在環境工程領域微波誘導催化技術推廣應用較為廣泛,在模擬單一成分廢水降解方面采用微波-活性炭工藝的研究較多。Fen-ton法在高濃度、難降解廢水降解領域有著較強的優勢,因其設備簡易、費用少、操作簡單、反應快速等倍受青睞。
在微波場中,Fenton試劑存在條件下引入活性炭,活性炭活性中心上吸附Fe2+、有機污染物等,對羥基自由基(•OH)附近污染物濃度有增大作用,可實現去除污染物、增強氧化效率的目的。微波穿透能力很強,有效降低反應活化能,對•OH釋放有利,增大•OH生成率,使Fenton反應活性大幅度提高,能取得較好的降解效果。
本研究采用活性炭-微波-Fenton組合技術對UDMH廢水進行處理,探討主要降解中間產物甲醛與氰根離子的變化規律,并對COD濃度與時間的關系進行線性擬合,以期為UDMH廢水處理的工藝應用及優化提供理論參考。
1、實驗
1.1 試劑與儀器
UDMH模擬廢水,由偏二甲肼樣品與去離子水配制而成,其中UDMH質量濃度為400mg/L,COD質量濃度為820mg/L;偏二甲肼,純度為99.2%,無色透明溶液;顆粒活性炭,粒徑700~2360μm,碘吸附值850mg/g,強度94%,水分不大于5%,灰分不大于15%,比表面積1200m2/g;重鉻酸鉀、過氧化氫、硫酸亞鐵、氫氧化鈉、磷酸氫二鈉、甲醇、氨水、氨基磺酸銨、氯化鈣、硫酸銨、硫酸、鹽酸、氯化鈉、檸檬酸、乙酰丙酮、冰乙酸、吡啶-巴比妥酸、亞硝基鐵氰化鈉、乙酸銨,以上試劑均為分析純。
經改裝(加回流冷凝裝置)WP700(MS-2004TMS-2014T)型LG微波爐;PHS-3C型酸度計;721可見分光光度計司;DZF-6020真空干燥箱;79-1型磁力攪拌器;SHB-Ⅲ循環水式多用真空泵。
1.2 分析測定方法
UDMH含量采用氨基亞鐵氰化鈉分光光度法測定;COD含量采用消解分光光度法測定;HCHO含量采用乙酰丙酮法進行測定;CN-含量采用吡啶-巴比妥酸分光光度法進行測定。
1.3 實驗方法
稱取適量顆粒活性炭,用質量分數為5%的稀鹽酸浸泡24h,然后用蒸餾水多次淋洗呈中性,置于130℃真空干燥箱干燥12h至恒重,裝入細口瓶中備用。
室溫下,取一定量經處理后的活性炭于250mL磨口燒瓶中,加入100mL預先配制好的質量濃度為400mg/L的UDMH廢水,調節溶液的pH值,再加入適量H2O2及FeSO4溶液(n(Fe2+)∶n(H2O2)按1∶6、1∶8、1∶10、1∶12分別進行配置)。將燒瓶置于微波爐,打開冷卻水,調節微波功率并設好時間開始加熱。待反應完全結束后,取出燒瓶并冷卻至室溫,將水樣過濾,測定原始廢水及處理后的廢水在500nm處的吸光度值,計算UDMH的去除率;測定COD值,計算COD去除率;測定HCHO及CN-的含量。
2、結果與討論
2.1 H2O2體積與COD去除率的關系
在pH值為3、微波功率為460W、活性炭質量為3g、n(Fe2+)∶n(H2O2)=1∶10時,加入不同體積的68.5g/L的H2O2溶液,以6、12、18、24、30min為采樣時間點,H2O2體積與COD去除率的關系曲線見圖1。
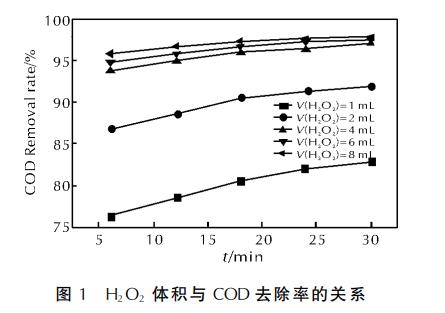
由圖1可看出,隨著H2O2體積增多,COD去除率增高。在H2O2體積為1mL時,COD去除率顯著低于2、4、6、8mL時的值。當反應進行到6min時,體積為4、6、8mL的COD去除率即可達93.5%以上,而當反應時間延長至10~30min時,COD去除率增高幅度不大。由此可得,在微波、活性炭存在下,Fenton反應在較短的時間內就能趨于平衡。當H2O2體積增加到4mL時,COD在30min時的去除率已達97.1%。這是因為:隨著H2O2體積的增加,•OH生成速率增加,2+形成速率增大,使得Fe2+的生成速率加快,H2O2分解生成•OH的速率隨之增加。考慮到成本因素,H2O2取4mL為佳。
2.2 微波功率與COD去除率的關系
在pH值為3、質量濃度為68.5g/L的H2O2體積為4.0mL、活性炭質量為3g、n(Fe2+)∶n(H2O2)=1∶10時,改變微波功率,以6、12、18、24、30min為采樣時間點,得到微波功率與COD去除率的關系曲線見圖2。
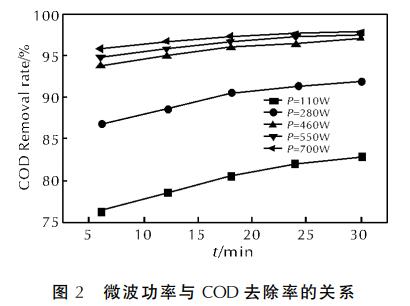
由圖2可得,微波功率不同,COD去除率均隨時間延長而增高,且功率越大,去除率就越高,達到平衡所需時間就越短。當進行到30min時,460、550、700W條件下的COD去除率都趨于97%~98%。增大微波功率,雖能增加Fenton反應速率,但對COD去除率影響甚微。分析認為,增大微波功率,使Fenton反應速率提高;同時,可使活性炭表面的“熱點”數量增加,強化活性炭對COD的吸附作用,使得去除率增高。綜合考慮,微波功率選取460W最佳。
2.3 pH值與COD去除率的關系
在微波功率為460W、68.5g/L的H2O2體積為4.0mL、活性炭質量為3g、n(Fe2+)∶n(H2O2)=1∶10時,改變pH值,考察其對COD去除率的影響,結果見圖3。
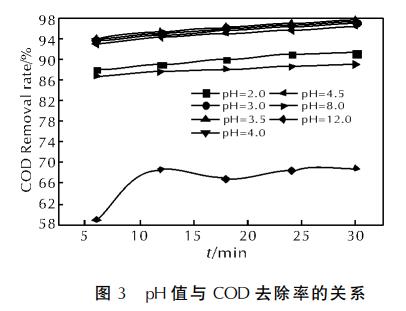
從圖3可看出,COD在反應前6min內去除較為明顯。當pH值分別為2、3、3.5、4、4.5、8時,反應在6min內COD去除率已較大,而后趨于平衡。pH值為3.5時COD去除率最高,達97.5%。而當pH值為12呈弱堿性時,COD去除率僅為68.9%。
在pH值大于7時,H+容易和OH-相結合,除了有利于•OH生成外,還促進活性炭對COD的吸附。pH值增高,對•OH的釋放有抑制作用。但pH值過低,H+抑制Fe3+朝Fe2+轉化,即Fe3+不能被還原為Fe2+。當pH值過高時,Fe3+和OH-易于生成Fe(OH)3沉淀,抑制Fenton反應的進行。pH=8的弱堿性環境下,COD去除率可達89%,這說明微波、活性炭的存在可在一定程度上削弱pH值對Fenton反應所造成的負面影響。本實驗條件下,pH值選3.5較為適宜,這與Fenton試劑的pH值使用范圍一致。
2.4 Fe2+投入量與COD去除率的關系
在pH值為3.5、微波功率為460W、68.5g/L的H2O2體積為4.0mL、活性炭質量為3g時,以n(Fe2+)∶n(H2O2)分別為1∶6、1∶8、1∶10、1∶12對UDMH廢水進行處理,實驗結果見圖4。
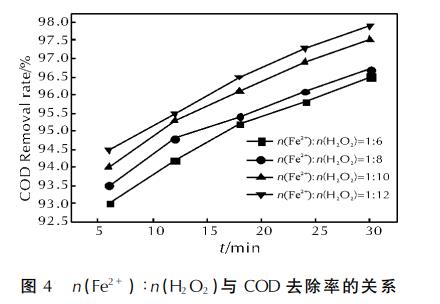
由圖4可看出,隨著n(Fe2+)∶n(H2O2)的減小,COD去除率增高,但各n(Fe2+)∶n(H2O2)比值條件下的COD去除率增幅不太明顯,比值為1∶6與1∶8時的COD去除率較為接近,反應30min時可達96.5%以上;比值為1∶10與1∶12時的COD去除率相差不大,反應30min時可達97.5%以上。這說明Fe2+是促使H2O2分解產生•OH的催化劑。Fe2+濃度不高時,H2O2較難產生•OH,反應速率低;隨著Fe2+濃度的增大,反應速率加快;Fe2+濃度繼續增加,過量Fe2+可能和•OH起反應,不斷消耗掉•OH,使Fenton反應速率減慢,降低COD去除率。因此,選擇n(Fe2+)∶n(H2O2)=1∶10較為合適。
2.5 活性炭投入量與COD去除率的關系
在pH值為3.5、微波功率為460W、68.5g/L的H2O2體積為4.0mL、n(Fe2+)∶n(H2O2)=1∶10時,調整活性炭用量,考察其對處理效果的影響程度,結果見圖5。

由圖5可看出,隨著活性炭投入量的增大,COD去除率增高。這是由于活性炭有著良好的吸附作用,活性炭用量越多,比表面積越大,吸附性能越好。隨著活性炭投入量的增加,越來越多的“熱點”(在微波輻射下,可觀察到活性炭表面出現火花)在微波場中形成,此“熱點”處能量與溫度比其他地方高出許多,被吸附的物質易于在該位點上發生物理化學作用,催化降解速率加快,對污染物的去除有利。這種將微波能量得以聚集并釋放給水中污染物使之氧化分解的結果表明,活性炭的作用符合催化劑的定義,在本反應中活性炭幾乎無消耗。COD去除率在活性炭質量為7g時達最高。但當活性炭質量大于5g后,COD去除率僅略為增高。因此,選取5g活性炭進行實驗研究。
2.6 最佳實驗條件下UDMH的降解
在微波功率為460W、68.5g/L的H2O2體積為4mL、pH值為3.5、n(Fe2+)∶n(H2O2)=1∶10、活性炭質量為5g的條件下,以6、12、18、24、30min為采樣時間點,廢水UDMH的去除率分別為96%、97.1%、97.9%、98.8%、99.3%。可以看出,活性炭-微波-Fenton體系在實驗進行到30min時,UDMH去除率高達99.3%。微波輻射可加快活性炭吸附催化降解UDMH速率,對吸附體積起增大作用。在微波場中,H2O2易釋放•OH,使反應活化能降低,加速Fenton的反應進程。H2O2、Fe2+、微波、活性炭的協同效應顯著提高了體系的氧化能力,使得廢水中UDMH及COD均有很高的去除率。
2.7 降解過程中主要中間產物的變化規律
UDMH降解過程中中間產物主要為甲醛、氰根離子,含量較高、毒性較大,且存在時間較長。
2.7.1 甲醛的變化規律
在微波功率為460W、68.5g/L的H2O2體積為4mL、pH值為3.5、n(Fe2+)∶n(H2O2)=1∶10、活性炭質量為5g的條件下,分析廢水中甲醛的質量濃度隨時間的變化規律,結果如圖6所示。
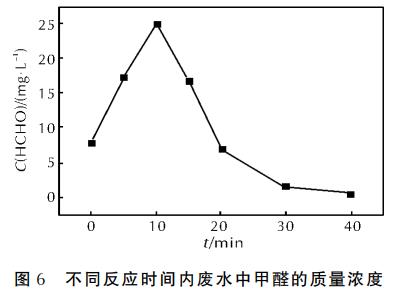
由圖6可知,未經處理的廢水中已含有質量濃度為7.9mg/L的甲醛,這可能是由于久置的緣故,有少量甲醛生成。隨著反應時間的延長,UDMH逐漸降解,甲醛的質量濃度發生了變化。反應起始,甲醛的質量濃度急劇增加,10min時達到峰值。此后,甲醛質量濃度迅速降低,在30min處甲醛質量濃度已經極少,這表明甲醛是活性炭-微波-Fenton反應降解UDMH的一種中間產物。此外,甲醛質量濃度在10min后呈直線狀降低也證明了該反應體系具有超強的氧化能力。
2.7.2 氰根離子的變化規律
在微波功率為460W、68.5g/L的H2O2體積為4mL、pH值為3.5、n(Fe2+)∶n(H2O2)=1∶10、活性炭質量為5g的條件下,分析廢水中氰根離子(CN-)的質量濃度隨時間的變化,結果如圖7所示。
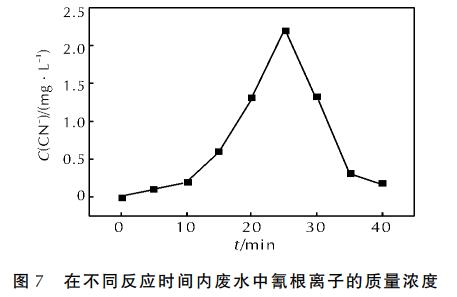
從圖7可以看出,未經處理的廢水中是不含CN-的。隨著反應時間的延長,CN-經歷了從生成至達到質量濃度最高值,然后迅速降低的過程。在反應開始時,隨著UDMH的降解,CN-也隨之產生,25min時質量濃度達到最大值。之后CN-迅速被氧化,在40min處CN-基本消除。由此可知,雖然CN-是一種較難降解的中間產物,但在活性炭-微波-Fenton反應體系中基本可以降解完全。這說明該反應體系不僅對UDMH、COD有很好的去除效果,對UDMH的中間產物甲醛、氰根離子同樣可達到很好的降解效果。
2.8 反應動力學方程
由上述最佳反應體系處理廢水的結果,探討COD去除率的動力學規律。以反應時間t為橫坐標、ln(C0/C)為縱坐標作圖(C0為廢水水樣中COD的初始質量濃度,C為處理后水樣中COD的質量濃度),結果如圖8所示。

由圖8可得,廢水中的COD去除率遵循一級反應動力學特征,動力學方程為:ln(C0/C)=0.00355t+0.1755,R2=0.9959,表明該擬合結果較為理想。
3、結論
(1)通過活性炭-微波-Fenton聯用技術對UDMH廢水進行處理,得到的最佳反應條件為:微波功率為460W、68.5g/L的H2O2體積為4mL、pH值為3.5、n(Fe2+)∶n(H2O2)=1∶10、活性炭質量為5g、反應時間為30min;在最佳反應條件下,初始質量濃度為400mg/L的UDMH廢水去除率為99.3%,COD去除率可達98.0%。此外,還可有效降解甲醛及氰根離子等中間產物。
(2)反應動力學研究表明,廢水中的COD去除率遵循一級反應動力學特征,動力學方程為:ln(C0/C)=0.00355t+0.1755,相關性達0.9959。
(3)活性炭-微波-Fenton組合技術處理UDMH廢水,在反應開始6min內即可達到較為理想的效果,具有反應迅速的特點。此外,該技術操作方便、成本低廉、無二次污染、裝置簡單且占地面積小、有機物礦化度高,是一種高效的UDMH廢水處理技術。(來源:上海空間推進研究所,上海空間發動機工程技術研究中心)



