剩余污泥中纖維素半纖維素微生物降解技術(shù)
中國污水處理工程網(wǎng) 時間:2016-3-7 8:35:58
污水處理技術(shù) | 匯聚全球環(huán)保力量,降低企業(yè)治污成本
1 引言
剩余污泥中存在著相當數(shù)量難以生物降解的木質(zhì)纖維素.一方面,這些木質(zhì)纖維素難以在厭氧消化過程中被降解、轉(zhuǎn)化,使得能源(甲烷)產(chǎn)率過低.另一方面,殘留在消化污泥中的木質(zhì)纖維素也阻礙污泥減量,為污泥填埋處置形成潛在隱患(Mottet et al., 2010).
研究表明,木質(zhì)纖維素是一種由纖維素、半纖維素和木質(zhì)素組成的聚合物.其中,木質(zhì)素最難降解,且在厭氧條件下無法實現(xiàn)有效降解;而纖維素和半纖維素相對容易降解并轉(zhuǎn)化.如果能實現(xiàn)木質(zhì)纖維素其中2組分(纖維素、半纖維素)完全降解,不僅污泥能源轉(zhuǎn)化率將會提高,而且也會對污泥減量起到一定的促進作用.污泥厭氧消化實踐表明,傳統(tǒng)厭氧消化幾乎對木質(zhì)纖維素沒有降解.這表明,傳統(tǒng)厭氧消化系統(tǒng)中很少或幾乎不存在降解復雜化學結(jié)構(gòu)木質(zhì)纖維素的微生物.
面對上述實際情況,本研究旨在通過微生物富集培養(yǎng)方法去探知消化污泥中是否存在可降解纖維素/半纖維素的厭氧微生物,為后續(xù)研究污泥中木質(zhì)纖維素厭氧生物降解奠定實驗基礎.如上述,纖維素和半纖維素生物降解相對容易,這是因為這2種組分在結(jié)構(gòu)上具有一定的相似性,如木聚糖(半纖維素主要成分)和纖維素都是由單糖經(jīng)β-1,4糖苷鍵鏈接而成,它們的降解均是依靠胞外酶打破β-1,4糖苷鍵而實現(xiàn).可見,可以通過富集培養(yǎng)降解一種物質(zhì)的微生物便可實現(xiàn)對木質(zhì)纖維素2種組分的同步降解.本研究中微生物富集培養(yǎng)實驗也就由此開始.
2 實驗材料與方法
2.1 種泥與基質(zhì)
富集培養(yǎng)木質(zhì)纖維素厭氧生物種泥分別取自北京市某大型市政污水處理廠剩余污泥(實際污泥)與實驗室發(fā)酵罐中厭氧培養(yǎng)污泥(消化污泥).實際污泥為污水處理廠脫水后污泥(含水率:80%),實驗時按需要濃度進行兌水稀釋.消化污泥原污泥來源于實驗室一合成配水的SBR脫氮除磷中試裝置剩余污泥;用于消化污泥培養(yǎng)的發(fā)酵罐工作體積為4 L,在T=35 ℃、SRT=20 d、pH=7.0工況下運行.
選擇木聚糖作為木質(zhì)纖維素降解微生物富集培養(yǎng)的唯一基質(zhì),因為它相對于纖維素來說,結(jié)構(gòu)疏松,無晶體結(jié)構(gòu),聚合度低,較容易被降解.
2.2 富集培養(yǎng)系統(tǒng)
富集培養(yǎng)采用系列平行搖瓶實驗,配備有密封橡膠塞的250 mL血清瓶作為富集培養(yǎng)系統(tǒng).血清瓶置于空氣浴恒溫搖床(T=35 ℃;搖動速度100 r · min-1)內(nèi)進行實驗.
兩種不同來源的種泥在血清瓶中的污泥濃度分別為:①實際污泥:MLSS≈22.28 g · L-1,MLVSS≈14.56 g · L-1;②消化污泥:MLSS≈22.37 g · L-1,MLVSS≈17.69 g · L-1.兩種污泥分別設置3個平行樣(編號:1、2、3),并各設置1個不加基質(zhì)的空白樣瓶.實驗中,以6 d作為1個周期進行底物置換,并進行相應指標檢測,具體實驗方案列于表 1.細菌培養(yǎng)所需微量元素通過向血清瓶分別添加DIN EN ISO 11734 L47(簡稱L47)和DIN EN ISO 11734(簡稱M)培養(yǎng)液來補充,其成分見表 2.
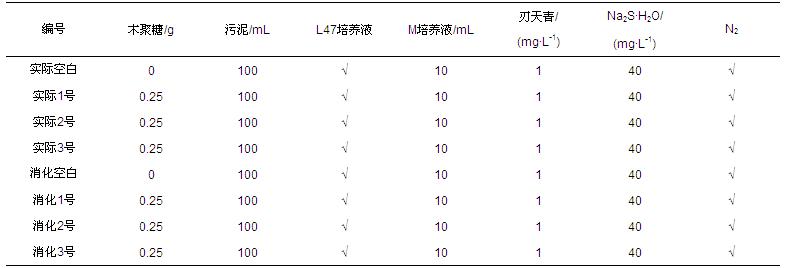
表1 微生物富集培養(yǎng)實驗方案 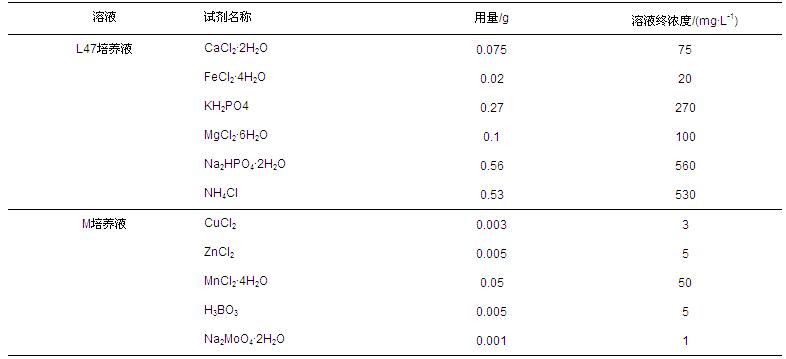
表2 培養(yǎng)液組成
在富集實驗伊始,即使存在木聚糖降解類微生物,它們也不是優(yōu)勢菌種.所以,木聚糖如能降解,首先會形成單糖,隨后會被占優(yōu)勢的產(chǎn)甲烷菌轉(zhuǎn)化為CH4和CO2.因此,可根據(jù)血清瓶產(chǎn)氣情況來作為木聚糖是否降解之指示.另外,木聚糖降解微生物主要是以分泌胞外酶的形式來水解木聚糖,且胞外酶之活性又與微生物的活性呈正比.故此,系統(tǒng)中的木聚糖酶活性可用作為一種指標,以此判斷系統(tǒng)中木聚糖降解微生物的生物活性.
2.3 氣體組分測定
實驗中采用氣相色譜儀(GC-2014型)檢測血清瓶中產(chǎn)生的甲烷等氣體,測定方法為外標法;選取標定物為高純度標準氫氣和甲烷制定標準曲線,如圖 1所示.
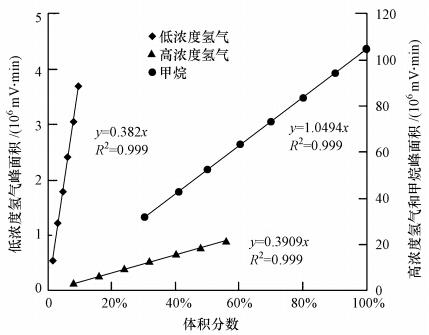
圖 1 氣相色譜標準曲線
2.4 木聚糖酶活性測定
2.4.1 測定原理
木聚糖經(jīng)過木聚糖酶水解后會生成寡糖和單糖.由于寡糖具有還原性末端和單糖具有還原基團,所以,導致兩者在沸水浴條件下與DNS試劑會發(fā)生顯色反應.因顯色反應顏色強度與酶解產(chǎn)生的還原糖量成正比,且還原糖量又與待測液中木聚糖酶活性成正比,所以,可通過顯色反應強度來推算木聚糖酶活性.
2.4.2 測定方法
取 1%木聚糖標準溶液3.6 mL,滴入25 mL 具塞刻度試管中;加入0.4 mL適當稀釋的富集培養(yǎng)上清液,于35 ℃水浴鍋中保溫30 min;加入6 mL DNS溶液,混勻,沸水浴15 min;冷卻至室溫,定容到25 mL,在540 nm測定溶液吸光度.平行測定加入滅活上清液的空白對照組.
2.4.3 酶活性計算方法
木聚糖酶活性單位是指每min催化木聚糖水解生成1 μmol木糖所需的酶量,其中一個酶活性單位為U.酶活性計算公式(李彩霞等,2001)為:
式中,H為木聚糖酶酶活性(U · mL-1);D為酶液稀釋倍數(shù);V1為比色管定容體積(mL);CX為木糖濃度(μmol · mL-1);T為反應時間(min);V2為酶液體積(mL).
2.4.4 標準曲線
采用高純度木聚糖溶液制定標準曲線(外標法),標定溶液中木聚糖酶活性,測得的標準曲線如圖 2所示.該方法可準確地檢測出反應液中的木糖含量,從而可以根據(jù)計算公式推算出待測液中木聚糖酶活性.
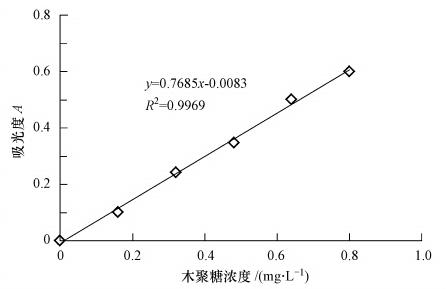
圖 2 木聚糖酶活性標準曲線
2.5 熒光顯微鏡鏡檢
本實驗,微生物實驗觀察采用熒光顯微鏡(Zeiss Axioskop 40,正置式)進行,并配備了熒光激發(fā)光源和濾光片組,以確保紅、綠、藍色熒光觀察能夠正常進行.此外,顯微鏡還配置以數(shù)碼相機,可實現(xiàn)對觀察到的微生物進行實時拍攝,并隨之通過配置的AxioVision軟件進行分析,以產(chǎn)生準確的數(shù)據(jù)信息.
2.6 熒光原位雜交(FISH)實驗
熒光原位雜交(FISH)被用于鑒定富集培養(yǎng)系統(tǒng)中細菌種類.首先,對測試泥樣用4%多聚甲醛固定2 h;再對固定后的泥樣離心,并在1×PBS 中重新懸浮(重復3次).其次,對泥樣進行機械破碎,并將破碎泥樣滴加在明膠包被的載玻片上,分別用50%、80%和98%酒精浸泡3 min.再次,將熒光標記的寡核苷酸探針(見表 3)溶解于雜交緩沖液中(組成:0.9 mol · L-1 NaCl,0.02 mol · L-1Tris-HCl(pH=7.4),0.01% SDS和35% 去離子甲酰胺(DFA)),并在46 ℃下與污泥樣品雜交2 h.雜交結(jié)束后,采用清洗液(組成:0.005 mol · L-1 EDTA(pH=8.0),0.02 mol · L-1 Tris-HCl(pH=7.2),0. 01%SDS和0.9 mol · L-1 NaCl)在48 ℃下洗脫20 min.最后,對每個污泥樣品用熒光顯微鏡(Zeiss Axioskop 40)隨機拍照并進行定量分析.
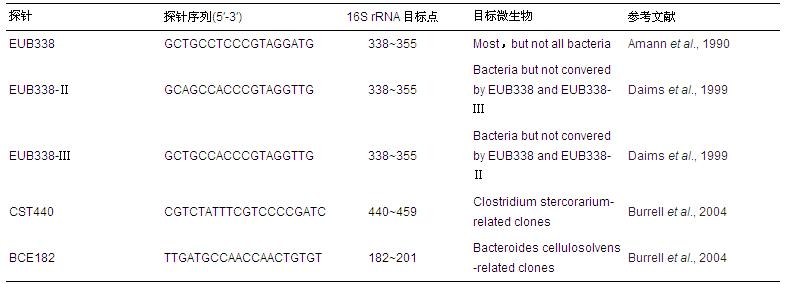
表3 鑒定木聚糖降解菌的寡核苷酸序列探針
2.7 細胞活性染色(LIVE/DEAD)
采用熒光染料對富集培養(yǎng)系統(tǒng)中的微生物進行染色,以確定富集培養(yǎng)系統(tǒng)中微生物的細胞活性,操作方法見參考文獻(Invitrogen Molecular Probes,2004; Ziglio et al., 2002).
3 結(jié)果分析與討論
3.1 產(chǎn)氣情況
血清瓶富集培養(yǎng)系統(tǒng)產(chǎn)氣變化曲線示于圖 3,甲烷產(chǎn)氣變化曲線示于圖 4,其中,實際污泥與消化污泥產(chǎn)氣曲線均以3組平行實驗數(shù)據(jù)求平均值繪制而成.

圖 3 總產(chǎn)氣量趨勢圖
圖 3顯示,未投加基質(zhì)——木聚糖的兩個空白樣之氣體產(chǎn)量隨時間推移逐漸減少,直至第10周期(60 d)時為零,說明空白樣因無外加碳源而只能進行內(nèi)源呼吸,直至內(nèi)源碳源消耗殆盡.反觀投加木聚糖血清瓶氣體產(chǎn)量,先升后降,先后出現(xiàn)兩個谷峰和谷底.這一產(chǎn)氣量變化趨勢說明,血清瓶中的木聚糖已被降解,即,兩種種泥中均存在著不同含量可降解木聚糖的厭氧微生物.
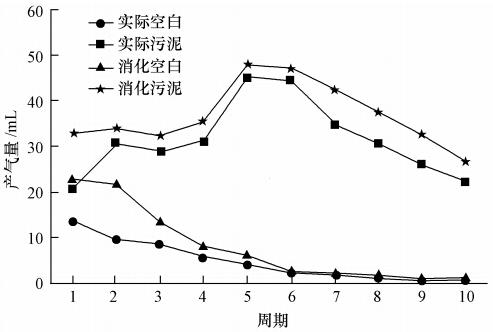
圖 4 CH4產(chǎn)氣量趨勢圖
圖 3、圖 4產(chǎn)氣量出現(xiàn)的連續(xù)谷峰、谷底圖形暗示,在實驗的伊始,可能因降解木聚糖之細菌較少而造成木聚糖少量降解與細菌內(nèi)源呼吸并行的狀態(tài),即,此時觀測到的產(chǎn)氣量為兩者的疊加(以內(nèi)源呼吸產(chǎn)氣量為主),開始出現(xiàn)第一個谷峰.第2周期后,內(nèi)源呼吸作用開始減弱,由此產(chǎn)生的氣量隨之減少,使得總產(chǎn)氣量隨之減少,以至于出現(xiàn)第一個谷底.從第3周期開始,血清瓶中富集培養(yǎng)的降解木聚糖細菌開始增多,使得木聚糖降解效果明顯增強,由此通過水解產(chǎn)生的單糖并形成甲烷的份額出現(xiàn)跳躍式上升,于第5、6周間出現(xiàn)第2個谷峰.木聚糖降解率提高也意味著被水解成的單糖轉(zhuǎn)化為揮發(fā)性有機酸(VFAs)的程度得以增強,導致pH開始下降,最終抑制了產(chǎn)甲烷細菌的活性,使產(chǎn)氣量不斷下降,以至于出現(xiàn)第2個谷底.
實際污泥與消化污泥產(chǎn)氣量高低略微不同的曲線表明,兩種種泥中均存在著可降解木聚糖的微生物,但消化種泥中因厭氧培養(yǎng)而含量較高.因此,在隨后投加富集木聚糖富集微生物實驗中選擇了厭氧消化培養(yǎng)種泥.
3.2 木聚糖酶活性
從第6周期開始,每周期開始檢測并計算系統(tǒng)中木聚糖酶活性狀況,結(jié)果如圖 5所示.與圖 3繪制數(shù)據(jù)處理相同,實際污泥與消化污泥酶活性曲線均以3組平行實驗數(shù)據(jù)求平均值繪制而成,與圖 3對應一致.

圖 5 木聚糖酶活性趨勢圖
圖 5顯示,兩組空白對照實驗中酶活性均保證不變并維持在一很低數(shù)值,說明因空白樣中未投加木聚糖而使得其中可降解木聚糖微生物未能得到富集培養(yǎng).相比之下,投加木聚糖的6組血清瓶中酶活性均顯示出趨勢一致的上升勢頭,說明其中已成功培養(yǎng)并富集到相當數(shù)量可降解木聚糖的微生物,這與圖 3顯示的產(chǎn)氣量變化曲線變化趨勢一致.實際污泥與消化污泥酶活性平均值顯示均是先穩(wěn)定增長,至第8周期時趨于平穩(wěn),說明了在整個富集培養(yǎng)過程中,可降解木聚糖微生物數(shù)量持續(xù)增長至穩(wěn)定.此外,消化污泥酶活性略高于實際污泥亦說明,消化種泥中可降解木聚糖微生物數(shù)量略多,與圖 3產(chǎn)氣量結(jié)果推測一致.
3.3 微生物鑒定
3.3.1 細菌形態(tài)觀察
對兩種不同種泥富集獲得 的污泥和上清液各取1 mL并稀釋10倍后,取一滴 至載玻片上;風干后用結(jié)晶紫染色1 min,并用蒸餾水洗凈后再次風干;置載玻片于顯微鏡下觀察,觀察到如圖 6所示的結(jié)果.
圖 6顯示,兩種種泥富集培養(yǎng)獲得木聚糖降解細菌均為游離分散狀態(tài).其中,實際污泥富集后的細菌形態(tài)主要為桿狀和球狀,即,細菌主要以球狀細菌及桿狀細菌為主;消化污泥中的細菌形態(tài)為球狀、桿狀還有少量絲狀,即,細菌除球狀細菌及桿狀細菌外,也有少量絲狀細菌.由細菌鑒定知識可知,從形態(tài)學角度只能確定出富集獲得微生物為梭狀芽孢桿菌、芽孢桿菌和擬桿菌種的一種或多種,但并不能確切甄別出到底屬于哪一種或哪幾種.因此,只有分子生物學方法才能具體鑒定出菌種的類別.
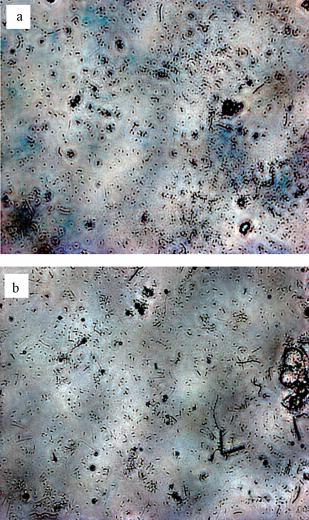
圖 6 富集污泥中細菌形態(tài)(a.實際污泥;b. 消化污泥)
3.3.2 FISH實驗
富集獲得細菌菌種經(jīng)FISH鑒定后結(jié)果示于圖 7.圖 7顯示,兩張圖片中均有綠色出現(xiàn),說明富集獲得微生物中梭狀芽孢桿菌屬和芽孢桿菌屬同時存在.此外,圖 7a顯示出較圖 7b多的綠色面積,說明富集獲得的微生物中以梭狀芽孢桿菌為主.由此可以斷定,富集獲得的微生物以梭狀芽孢桿菌為主,同時含有芽孢桿菌,為兩者的混合物.

圖 7 FISH圖像(圖中CY3標記探針CST440和BCE182為綠色,用于檢測降解木聚糖微生物;CY5標記的探針為紅色,用于標記所有微生物)
3.4 微生物活性比例(LIVE/DEAD)
LIVE/DEAD染色實驗顯微圖像結(jié)果示于圖 8.根據(jù)統(tǒng)計學分析可以得出,富集獲得的微生物活性分別為:實際污泥83.6%、消化污泥92.8%.這樣的實驗結(jié)果足以說明,實際污泥與消化污泥中細菌存活率均保持在很高水平,具有很高活性.具體參見污水寶商城資料或http://www.jianfeilema.cn更多相關技術(shù)文檔。
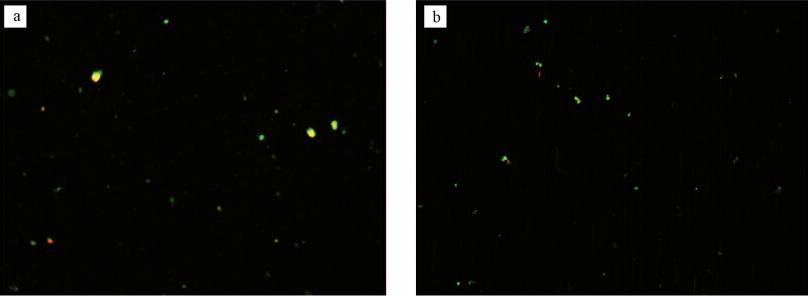
圖 8 LIVE/DEAD顯微圖像(a. 實際污泥;b.消化污泥; 圖中綠色為活菌;紅色為死菌;黃色為兩種熒光顏色疊加效果)
4 結(jié)論
通過兩種不同污泥投加同一底物——木聚糖進行可降解木聚糖微生物富集培養(yǎng)實驗得知,無論是從污水處理廠剩余污泥中還是實驗室發(fā)酵罐厭氧培養(yǎng)污泥中均可富集到相當數(shù)量(前者略低于后者)的可降解木聚糖微生物,說明污泥中至少存在著可厭氧降解纖維素和半纖維素的微生物.通過FISH與LIVE/DEAD實驗可知,富集獲得的木聚糖降解細菌處于游離分散狀態(tài),為梭狀芽孢桿菌屬和芽孢桿菌屬的混合物,以梭狀芽孢桿菌為主.從兩種不同種泥中獲得的富集微生物活性分別為:實際污泥83.6%,消化污泥92.8%,說明富集出的微生物具有很高的細菌活性.


