1 引言
聚丙烯酰胺(PAM)常用于3次采油以提高原油采收率,但通常伴隨大量含PAM的驅油廢水產生(Jeirani et al., 2014).聚合物驅油廢水中的PAM一般為陰離子型,濃度多為100~500 mg · L-1.與常規廢水相比,PAM的存在使得驅油廢水具有黏度大、油珠粒徑小、泥沙攜帶量大、油水難分離、污染物穩定性增強等特點(王啟民等,1999;梁偉等,2010),并且嚴重干擾絮凝劑的使用效果(羅立新,2010),采用常規方法處理難度較大(梁偉等,2010).因此,處理含PAM驅油廢水的關鍵是脫除PAM(詹亞力等,2003).前期研究(《分子篩吸附法脫除廢水中的聚丙烯酰胺》,《環境工程學報》待刊)中嘗試用不同類型的分子篩作為吸附劑,處理含PAM的油田廢水,結果表明,氫型Beta分子篩(H-Beta)對含PAM廢水具有良好的吸附效果,且遠優于蒙脫土、鈉基膨潤土、活性炭和活性白土等常規吸附劑.基于此,本文進一步研究在不同溫度和初始濃度下,PAM在H-Beta上的吸附動力學和熱力學,并考察吸附條件對H-Beta吸附PAM效果的影響,以及H-Beta對真實廢水的吸附能力,以期獲得PAM在H-Beta上的吸附特性和影響因素.
2 材料與方法
2.1 吸附試驗
H-Beta的制備如文獻(Eapen et al., 1994)所述,其部分物化性質如表 1所示.
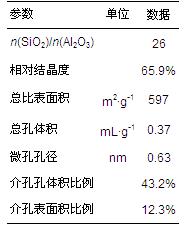
表 1 H-Beta分子篩的物化性質
吸附試驗采用油田驅油用的AP-P4陰離子型疏水締合PAM(工業品,四川光亞聚合物化工有限公司,分子量1400萬),將其與水配制成溶液.在50 mL的PAM溶液中加入吸附劑,用稀硝酸調節pH值,在一定溫度下振蕩一段時間,離心過濾.采用日本SHIMADZU公司的TOC-V CPH檢測儀測定溶液中總有機碳(TOC)含量.通過繪制TOC值與PAM濃度之間的標準曲線,然后根據所測樣品TOC值在該曲線上獲得PAM濃度.
2.2 吸附動力學
配制濃度分別為100、200和500 mg · L-1的PAM溶液,用稀硝酸調節溶液初始pH為4,然后加入相同質量的H-Beta吸附劑,在不同溫度(25、40和50 ℃)下恒溫振蕩處理,每隔一定時間取樣,測定TOC值,計算脫除率和吸附量.
2.3 吸附等溫線
配制不同初始濃度PAM溶液,用稀硝酸調節溶液pH=4,分別加入質量相同的吸附劑,分別在25、40和50 ℃下恒溫振蕩4~8 h至吸附平衡,離心過濾,測定濾液TOC值,得到PAM濃度.
3 結果與討論
3.1 吸附動力學
不同初始濃度(100、200和500 mg · L-1)和不同溫度(25、40和50 ℃)下,H-Beta對PAM的吸附量隨時間的變化關系如圖 1所示.
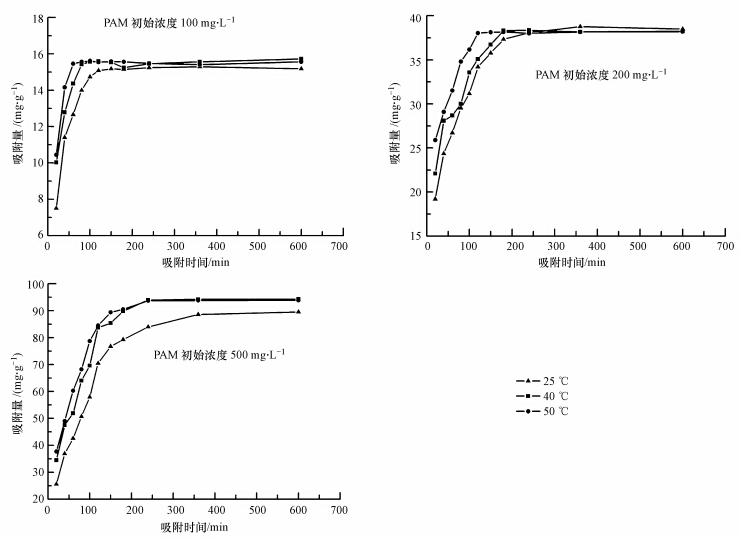
圖 1 不同初始濃度和溫度下PAM在H-Beta上的吸附動力學曲線
在不同的初始PAM濃度和吸附溫度下,H-Beta對PAM的吸附在初始階段均表現出較大的速率,吸附量快速上升,曲線較陡;隨著吸附進行,速率降低,吸附量增加不明顯,曲線趨緩,最后達吸附平衡.初始PAM濃度越低,達到平衡所需時間越短.在相同PAM初始濃度下,隨著溫度升高,H-Beta對PAM的吸附速率增加,達到吸附平衡所需時間逐漸降低.這與Yi等(2011)在研究PAM在PVDF UF 膜上的吸附時得到的結果一致.
采用準一級動力學方程(式(1))、準二級動力學方程(式(2))、Elovich方程(式(3))和顆粒內擴散模型(式(4))對上述動力學曲線進行擬合.
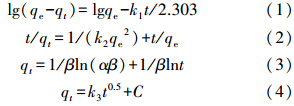
式中,qe為吸附達平衡時的吸附量(mg · g-1),qt為吸附時間為t(min)時的吸附量(mg · g-1),k1為準一級動力學速率常數(min-1),k2為準二級動力學速率常數(g · mg-1 · min-1),α為吸附速率常數(mg · g-1 · min-1),β為脫附常數(g · mg-1),k3為顆粒內擴散速率常數(g ·(mg · min0.5)-1),C為截距(mg · g-1).
按照上述4種動力學模型擬合得到的參數值列于表 2中.可見,在不同初始濃度和溫度條件下,準二級動力學方程可決系數最高(R2>0.99),說明其能較好地反映PAM在H-Beta分子篩上的吸附動力學特征.此外,在不同條件下,顆粒內擴散模型也具有較高的可決系數(R2>0.90),說明吸附可能受到內擴散控制;但擬合參數C值不為0,說明內擴散不是唯一的影響因素.
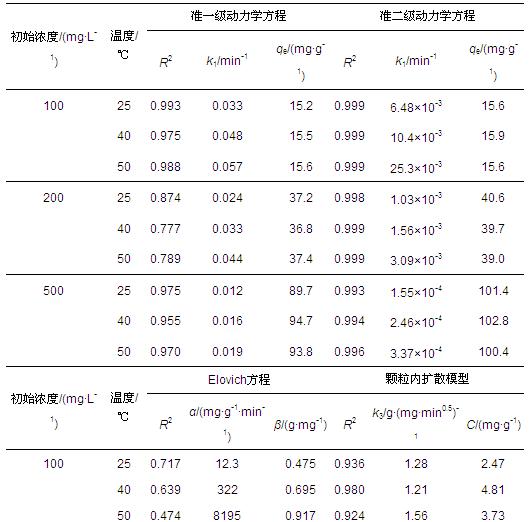
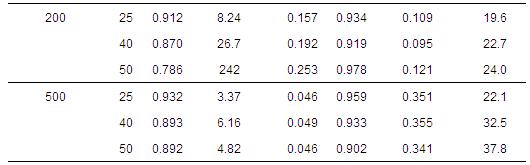
表 2 吸附動力學方程擬合參數
將lnk2對1/T作圖,具體如圖 2所示.根據Arrhenius方程計算初始濃度為100、200和500 mg · L-1時的表觀活化能(Ea)分別為41.8、33.8和24.8 kJ · mol-1.一般認為Ea在5~40 kJ · mol-1范圍內為物理吸附(Nollet et al., 2003),因此,當PAM初始濃度較低時,吸附過程表現為化學吸附特征,而隨著初始濃度的增加,Ea逐漸降低,此時,H-Beta對PAM的吸附則向物理吸附轉變.
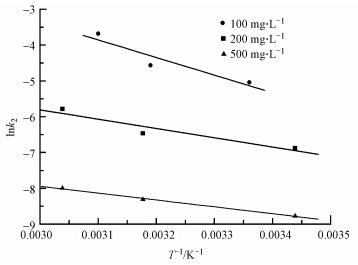
圖 2 不同初始濃度下的Arrhenius曲線
3.2 吸附熱力學
3.2.1 吸附等溫線
不同溫度下的吸附等溫線如圖 3所示.可見,PAM在H-Beta上的吸附過程分為兩段:第一段為低平衡濃度區,H-Beta對PAM的吸附量隨著平衡濃度的升高迅速升高,隨后達平臺區;第二段為高濃度區,H-Beta對PAM的吸附量隨平衡濃度的增加而持續增加.因此,將吸附等溫線劃分為低平衡濃度區和高平衡濃度區,在兩個濃度區均用Freundlich模型(式(5))和Langmuir模型(式(6))擬合數據,結果見表 3.
![]()
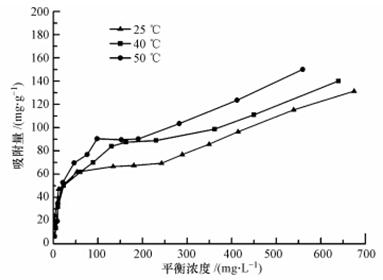
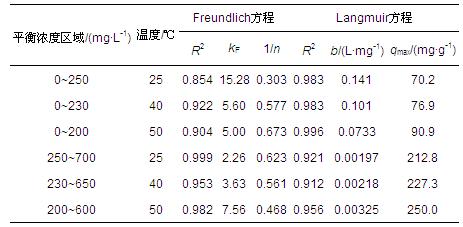
表 3 H-Beta吸附PAM的Freundlich和Langmuir參數
式中,qe為平衡吸附量(mg · g-1),Ce為吸附平衡時溶液濃度(mg · L-1),kF為Freundlich吸附常數,qmax為單層飽和吸附量(mg · g-1),b為Langmuir吸附常數(L · mg-1).
在低平衡濃度區,采用Langmuir模型所得可決系數較高(R2>0.98),等溫線平臺處表明吸附達到單層飽和.在25、40和50 ℃下,單層飽和吸附量qmax分別達70.2、76.9和90.9 mg · g-1.在高濃度區,Freundlich模型擬合所得可決系數較高(R2>0.95),說明形成多層吸附,這是由于PAM鏈上的疏水締合作用加強,形成了分子間締合,構成了具流變特征的網狀結構(Volpert et al., 1998),聚合物鏈相互纏繞而間接吸附在與分子篩表面直接接觸的PAM上(Lu et al., 2009),最終形成了多層吸附.這也可以解釋高濃度下,PAM在H-Beta上的吸附向物理吸附轉變.
3.2.2 吸附熱力學參數
吸附過程的熱力學參數(ΔGθ、ΔHθ、ΔSθ)計算方法如公式(7)和(8)所示,結果見表 4.
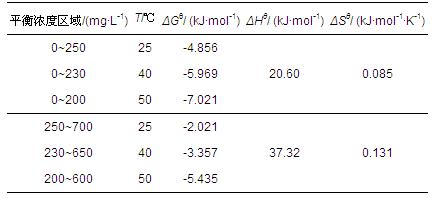
式中,K為平衡吸附常數,R為氣體常數(8.314×10-3 kJ · mol-1 · K-1),T為反應溫度(K).
Von Oepen等(1991)總結了不同作用力下吸附過程的|ΔHθ|范圍,指出氫鍵在2~40 kJ · mol-1之間,離子交換約為40 kJ · mol-1,化學鍵在63~84 kJ · mol-1之間,范德華力和疏水作用力等都<10 kJ · mol-1.結合表 4數據可以推斷,PAM在H-Beta分子篩上的主要吸附可能是氫鍵作用.另外,ΔHθ>0,說明PAM在H-Beta分子篩上的吸附是吸熱的.由ΔGθ<0可知,吸附是自發進行的.
3.3 吸附條件的影響
3.3.1 溶液pH值
為避免攪拌產生的剪切作用造成PAM斷裂,采用振蕩的方式將H-Beta與PAM溶液在25 ℃吸附4 h,考察pH值對不同初始濃度(100、200和500 mg · L-1)PAM溶液的吸附效果的影響,吸附性能如圖 4所示.
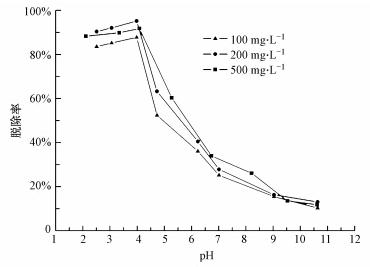
圖 4 pH值對PAM脫除率的影響
可見,當pH值為2~4時,H-Beta對PAM的吸附脫除率較高,吸附脫除率隨pH值增大略有增加;pH值繼續增大,H-Beta對PAM的吸附脫除率隨著pH值升高而顯著下降,對吸附的影響顯著.
本實驗采用的AP-P4為陰離子型PAM,其在溶液中的分子狀態及H-Beta的表面性質均會影響吸附效果,pH值對吸附產生的影響是靜電作用和PAM分子形態共同作用的結果.按照文獻(Milonji c ′ et al., 1975)對H-Beta測定的等電點(PZC點)為4.0.由此可知,pH值為2~4時,H-Beta呈正電性,與陰離子型PAM產生靜電引力,對吸附有利;反之,當pH值大于4時,H-Beta呈負電性而與PAM產生靜電斥力,不利于吸附.此外,PAM在高pH值下發生水解而造成酰胺基的減少,與H-Beta間的氫鍵作用減弱,不利于吸附.同時,PAM分子的有效體積隨著水解度增加而增大(熊啟勇等,2005),也造成H-Beta單位面積上吸附的分子減少,PAM脫除率降低.
3.3.2 吸附劑用量
針對不同初始濃度(100、200和500 mg · L-1),分別于50 mL PAM溶液中加入不同用量的H-Beta吸附劑(3、5、7和9 g · L-1),H-Beta的吸附性能如圖 5所示.
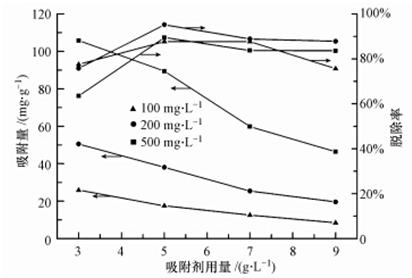
圖 5 吸附劑用量對PAM吸附量和脫除率的影響
可見,隨著吸附劑用量增加,總的吸附表面積增加,可提供更多的吸附位(程華麗等,2014),使PAM的脫除率提高,繼續增加吸附劑用量則導致脫除率有所下降.另外,吸附量也隨吸附劑用量的增加逐漸下降,這與魯秀國等(2014)發現的現象相似.這是因為吸附劑用量增加到一定程度后,彼此間可能出現團聚而造成可利用的吸附位數量減少(Wang et al., 2013),從而使得吸附位利用率下降.當吸附劑用量為5 g · L-1時,在3種初始PAM濃度下,都能得到最高的PAM脫除率.
3.4 H-Beta對真實廢水的吸附效果
采用中海油綏中36-1油田含AP-P4型PAM的采油廢水考察H-Beta對真實廢水的吸附性能及廢水中組分的競爭吸附.吸附條件為:吸附劑用量5 g · L-1,pH=4,25 ℃振蕩吸附4 h.吸附前后廢水的部分指標列于表 5.由于廢水中含油,影響TOC的測定,因此,采用文獻(茍紹華等,2014)的方法測定PAM濃度.油含量和金屬離子含量分別采用紫外熒光測油儀(OilTech 121A型)和原子吸收(AA-7020型)方法測定.

表 5 吸附前后真實廢水的部分指標
在真實廢水中,H-Beta不僅對PAM具有較高的脫除率(94.6%),而且還脫除了其中大部分的油和Ca2+及部分Mg2+.H-Beta的脫油能力來自于其較大的比表面積、豐富的孔道和獨特的拓撲結構(楊瀟健,2012).H-Beta能脫除金屬離子則是由于其擁有直通型孔道,可以進行陽離子交換(李學峰等,2011),對Na+幾乎沒有脫除效果,原因可能是Na+尺寸較大.為了考察競爭吸附的影響,配置了PAM含量與真實廢水相同的不含油和鹽的模擬廢水,在相同條件下用H-Beta進行吸附,結果發現,H-Beta對PAM的脫除率為91.3%.這說明真實廢水中的油和鹽類并不會與PAM產生競爭吸附而抑制PAM的脫除,反而在一定程度上促進了PAM的吸附.這可能是因為鹽類的存在中和了PAM長鏈上的負電荷,使其長鏈更加卷曲,旋轉半徑減少(Muller et al., 1979),因而吸附劑的單位比表面積上能吸附更多的PAM(祝艷榮等,2001).具體參見污水寶商城資料或http://www.jianfeilema.cn更多相關技術文檔。
4 結論
1)H-Beta對PAM的吸附動力學可用準二級動力學方程描述,粒子內擴散不是吸附過程唯一的控制步驟;初始濃度為100、200和500 mg · L-1時的吸附表觀活化能分別為41.8、33.8和24.8 kJ · mol-1.
2)H-Beta對PAM的吸附等溫線在低平衡濃度區符合Langmuir吸附特征,25、40和50 ℃時單層飽和吸附量qmax分別達到70.2、76.9和90.9 mg · g-1;在高平衡濃度區符合Freundlich方程;吸附為自發吸熱過程,主要吸附可能是氫鍵作用.
3)在體系pH值2~4和吸附劑用量為5 g · L-1條件下,H-Beta有較好的吸附效果.
4)真實廢水中的油和鹽類不會與PAM造成競爭吸附而降低H-Beta的吸附效果,H-Beta對真實廢水中PAM的脫除率可達94.6%,并且廢水中大部分油類和Ca2+及部分Mg2+也同時被脫除.


