Fenton試劑氧化法因其反應快速和成本低廉等優點而受到廣泛的研究和應用。1964年Eisenhouser首次使用Fenton試劑處理苯酚及烷基苯的廢水,開創了Fenton試劑在環境污染物處理中應用的先例。但傳統的Fenton試劑氧化法在處理污水的過程中容易產生二次污染,且對反應體系的pH要求較為苛刻。因此,傳統的均相Fenton試劑氧化法逐漸被非均相Fenton試劑氧化法替代。將Fe固定在載體(如硅膠、Al2O3、分子篩以及黏土材料)上,通過形成非均相Fenton反應體系,可擴大反應體系的pH適用范圍,并減少鐵污泥造成的二次污染。此外,研究發現,通過摻雜金屬的方法改變Fenton反應的催化劑,可促進氧化性活性物種的產生;促進電子轉移,加速不同價態金屬之間的循環;增大比表面積,增強吸附性能。但用稀土元素輔助的類Fenton反應還鮮有報道。稀土元素同過渡族元素一樣具有變價性能,可促進Fe(Ⅱ)與Fe(Ⅲ)之間的轉換,從而提高類Fenton反應的效率。
本工作以靛藍為目標污染物,采用稀土元素Pr輔助的類Fenton試劑氧化法處理模擬染料廢水。制備了雙金屬氧化物催化劑Fe2-xPrxO3,考察了催化劑中n(Pr)∶n(Fe)、催化劑加入量、初始靛藍質量濃度、H2O2加入量、廢水pH對廢水脫色效果的影響。
1 實驗部分
1.1 試劑和儀器
靛藍、Pr6O11、Fe(NO3)3、30%(w)H2O2溶液、HNO3、NaOH:分析純。
廢水:靛藍水溶液模擬的染料廢水。
UV-2550型紫外可見分光光度計:日本島津分析儀器公司;JB-3型定時恒溫磁力攪拌器:上海電磁新經儀器公司;DL-SM型離心機:長沙湘儀離心機有限公司;YFX12/16Q-YC型馬弗爐:上海意豐電爐有限公司;PHB-4型便攜式pH計:上海三信儀表廠。
1.2 催化劑的制備
采用共沉淀法,引入稀土元素Pr,制備雙金屬氧化物催化劑Fe2-xPrxO3,步驟如下。
將一定量的Pr6O11粉末加入一定量1 mol/L的HNO3中,在溫度為60 ℃、頻率為80 kHz的條件下超聲處理2 h,使其充分溶解,然后稀釋成0.1 mol/L的Pr(NO3)3溶液。
將0.1 mol/L的Pr(NO3)3溶液與0.1 mol/L的Fe(NO3)3溶液以不同的n(Pr)∶n(Fe)混合均勻,室溫下在磁力攪拌器的作用下緩慢滴加適量的NaOH溶液。沉淀完全后,置于90 ℃的水浴鍋中老化1 h,然后再在室溫下冷卻2 h。抽濾,所得固體離心洗滌3次后,于恒溫干燥箱中干燥4 h,取出研磨成均勻粉末,最后置于馬弗爐中煅燒8 h,即得所需催化劑。
1.3 實驗方法
取100 mL廢水置于燒杯中,用HNO3或NaOH溶液調節廢水pH,并加入一定量的催化劑和一定量的H2O2,在磁力攪拌器上反應一段時間。每隔10min取樣,以3 000 r/min的轉速離心5 min,取上清液進行測定。
1.4 分析方法
采用紫外可見分光光度計測定上清液在波長610 nm處的吸光度,從而計算廢水脫色率。
2 結果與討論
2.1 Pr與Fe的摩爾比對廢水脫色率的影響
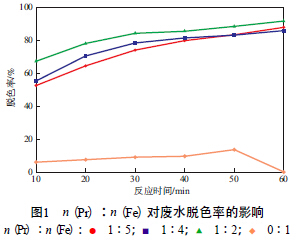
在催化劑加入量為500 mg/L、初始靛藍質量濃度為30 mg/L、H2O2加入量為40 mL/L、廢水pH為7的條件下,n(Pr)∶n(Fe)對廢水脫色率的影響見圖1。由圖1可見,加入Pr的催化劑使廢水的脫色效果得到了明顯提高,且n(Pr)∶n(Fe)越大,脫色效果越好。這是因為,Pr促進了Fe(Ⅱ)與Fe(Ⅲ)之間的轉換,增強了催化性能,從而提高了降解效率,使得廢水脫色率增加。綜合考慮經濟因素和脫色效果,選擇n(Pr)∶n(Fe)=1∶5的催化劑作為進一步的研究對象。
2.2 初始靛藍質量濃度對廢水脫色率的影響
在n(Pr)∶n(Fe)=1∶5、催化劑加入量為500 mg/L、H2O2加入量為40 mL/L、廢水pH為7的條件下,初始靛藍質量濃度對廢水脫色率的影響見圖2。
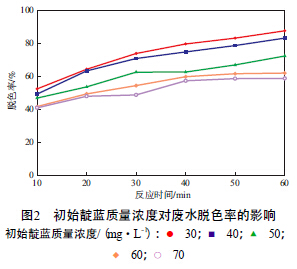
由圖2可見,廢水脫色率隨初始靛藍質量濃度的增加而減小,降解反應60 min,初始靛藍質量濃度為30,40,50,60,70 mg/L時的廢水脫色率分別達到87.71%,83.29%,72.42%,62.12%,58.87%。這是因為,初始靛藍質量濃度的增大在一定程度上減少了活性基團與有機物的作用幾率,并導致催化劑產生的·OH不足以氧化有機物,從而使廢水脫色率降低。因此,選擇初始靛藍質量濃度為30 mg/L。
2.3 催化劑加入量對廢水脫色率的影響
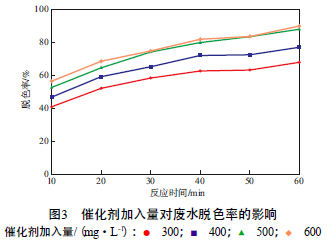
在n(Pr)∶n(Fe)=1∶5、初始靛藍質量濃度為30 mg/L、H2O2加入量為40 mL/L、廢水pH為7的條件下,催化劑加入量對廢水脫色率的影響見圖3。由圖3可見:隨催化劑加入量的增大,廢水脫色率明顯提高;而當催化劑加入量達到500 mg/L時,脫色率開始趨于穩定。這是因為,當催化劑加入量較少時,產生的·OH不足以有效降解有機物;但若加入量太大,則易產生過多的Fe2+,反而使·OH濃度降低,導致脫色率下降,且易產生二次污染。綜合考慮,選擇催化劑加入量為500 mg/L。
2.4 H2O2加入量對廢水脫色率的影響
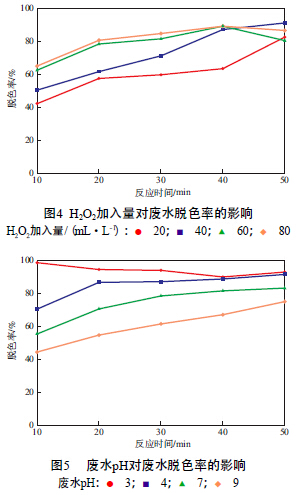
在n(Pr)∶n(Fe)=1∶5、初始靛藍質量濃度為30 mg/L、催化劑加入量為500 mg/L、廢水pH為7的條件下,H2O2加入量對廢水脫色率的影響見圖4。由圖4可見:當H2O2加入量較低時,產生的·OH太少,有機物不能充分的降解,致使廢水脫色率較低;當H2O2加入量較高時,產生的·OH又被其他反應消耗掉了,導致廢水脫色率出現下降趨勢。因此,選擇H2O2加入量為40 mL/L。
2.5 廢水pH對廢水脫色率的影響
在n(Pr)∶n(Fe)=1∶5、初始靛藍質量濃度為30 mg/L、催化劑加入量為500 mg/L、H2O2加入量為40 mL/L的條件下,廢水pH對廢水脫色率的影響見圖5。由圖5可見:當pH在酸性范圍內時,廢水脫色率較高;pH=3時,廢水脫色率最高,反應50 min時可達到92.78%;相反,pH為堿性時,過量的OH-會與金屬離子反應生成沉淀,從而破壞類Fenton體系,不利于有機物的降解,導致廢水脫色率降低。因此,選擇廢水pH為3。具體參見http://www.jianfeilema.cn更多相關技術文檔。
3 結論
a)采用共沉淀法,引入稀土元素Pr,制得雙金屬氧化物催化劑Fe2-xPrxO3,在很大程度上提高了類Fenton反應的效率,廢水脫色率得到顯著提高,對反應體系的pH的適用范圍較寬。
b)稀土元素Pr輔助的類Fenton試劑氧化法處理廢水的最佳工藝條件為:催化劑中n(Pr)∶n(Fe)=1∶5,初始靛藍質量濃度30 mg/L,催化劑加入量500 mg/L,H2O2加入量40 mL/L,廢水pH 3。在此條件下,反應50 min時廢水脫色率可達到92.78%。


