1含硫廢水處理工藝的確定
1.1廢水水量水質情況
天津渤天化工責任有限公司無機鹽廠主要生產氯化鋇、硫氫化鈉和硫化鈉等產品,三個車間年排放廢水27萬t,主要水量來自硫化鈉車間的洗水和設備泄露等。廢水主要含無機鹽類物質,基本不含有機物,其中硫化物含量160~450mg/L,pH值8~9,水溫15~45℃。公司要求處理后將廢水的含硫量降低到10mg/L,然后進入生化處理系統。
1.2廢水處理工藝的確定
目前,國內外處理含硫廢水的方法很多,如堿吸收法、沉淀法、氣提法、生化法、氧化法等。廢水中硫化物的質量濃度為2000mg/L以上時,一般采用堿吸收法、沉淀法或氣提法處理,且能回收其中的硫化物。廢水中硫化物的質量濃度為50mg/L以下時,一般采用生化法處理,處理后的廢水能達到排放標準要求。廢水中硫化物的質量濃度為50~200mg/L時,國外趨向于采用濕式氧化法處理,其產物主要為硫酸鹽,但該法能耗大,對設備材質要求苛刻,國內企業特別是中小企業,不宜采用。根據業主對出
水水質要求及廢水水質情況,我們確定催化氧化法處理工藝。
2催化氧化法處理含硫廢水的實驗研究
2.1試驗裝置、試劑、分析方法
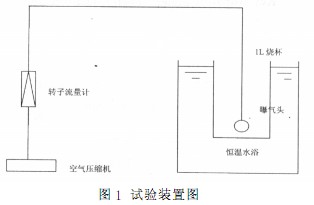
試驗裝置見圖1。該裝置采用空氣為氣源,用空氣壓縮機加壓后,通過轉子流量計控制氣體流量,曝氣頭采用砂芯曝氣頭,向1L燒杯中水樣充氧,形成氣液接觸,對水樣中S2-進行催化氧化,同時用恒溫水浴控制反應溫度,用秒表計時。
 |
試驗用試劑為硫酸錳、硫酸銅、硫酸亞鐵、氯化鈷、氫氧化鈉、硫化氨、乙酸鋅、乙酸鈉、磷酸、硫代硫酸鈉、硫化鈉、碘、淀粉,均為分析純,還有去離子水。
分析方法:測定硫化物的方法通常有對氨基二甲基苯胺光度法和碘量法。當水樣中硫化物含量小于1mg/L時,采用對氨基二甲基苯胺光度法,樣品中硫化物含量大于1mg/L時,采用碘量法。因此,本實驗硫化物用碘量法進行測定。原理為硫化物與乙酸鋅生成白色沉淀。將其溶于酸中,加入過量碘液,碘在酸性條件下和硫化物作用析出硫。然后用硫代硫酸鈉滴定剩余的碘,計算硫化物含量。
pH值測定采用玻璃電極法。pH值可間接地表示水的酸堿程度,是水化學中常用的和最重要的檢驗項目之一。由于pH值受水溫影響而變化,測定時應在規定的溫度下進行,或者校正溫度。通常采用玻璃電極法測定pH值。比色法簡便,但受色度、濁度、膠體物質、氧化劑、還原劑及鹽度的干擾。玻璃電極法不受以上因素的干擾,然而,pH值在10以上時,產生"鈉差",讀數偏低,需選用特制的"低鈉差"玻璃電極,或使用與水樣pH值相近的標準緩沖溶液對儀器進行校正。
2.2試驗方法
試驗采用(NH4)2S配制模擬水樣(水樣中S2-濃度為500mg/L),改變催化劑品種、催化劑用量、反應時間、反應溫度、曝氣量、反應液pH值等反應條件,記錄模擬水樣中S2-的去除率與這些條件改變的關系,通過分析得出最佳操作條件后,采用渤天無機鹽分廠水樣進行驗證。
2.3試驗結果
2.3.1曝氣頭充氧系數的測定
曝氣充氧過程屬于傳質過程,氧的總傳質系數在曝氣充氧過程中代表了氧的總傳遞性。氣膜中存在氧的分壓梯度,在液膜中存在氧的濃度梯度,這就是氧轉移的推動力。對于難溶解的氧來說,轉移的決定性阻力主要集中在液膜上。液膜內氧轉移的微分方程式為:
 |
實驗原理:采用間歇非穩態法進行充氧性能測定,即實驗時水不進不出,測定溶解氧濃度隨時間變化。實驗時向燒杯注滿所需水后,先用脫氧劑無水亞硫酸鈉和催化劑氯化鈷進行脫氧,然后在溶解濃度等于零的狀態下曝氣。在充氧過程中,水中溶解氧的濃度C是曝氣時間t的函數,測定水中溶解氧濃度是每隔15s記錄下溶解氧儀顯示的濃度值。
 |
測得,水深1m的情況下,砂芯曝氣頭的氧利用率為5%;折算成實際裝置水深150mm時,氧利用率為3%。
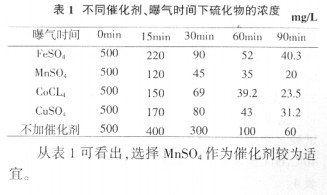
2.3.2催化劑的選擇
在常溫、常壓、無催化劑時,僅用空氣氧化廢水中的硫化物,需要很長的反應時間,但在某些催化劑的作用下可生成原子氧,使硫化物的氧化速度加快。醌類化合物和錳、銅、鐵、鈷、鎳等金屬的鹽類以及活性炭、過氧化物均具有催化作用。在試驗選擇了MnSO4、CuSO4、FeSO4、CoCl2四種金屬鹽催化劑進行篩選,試驗條件為室溫下,反應時間為2h,催化劑用量為MnSO41.4g/L、CuSO41.4g/L、FeSO41.41g/L、CoCl21.21g/L。試驗用水S2-濃度為500mg/L,pH為12,曝氣量100L/h。實驗結果見表1。
 |
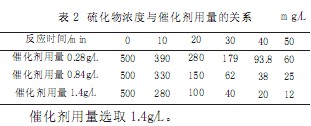
催化劑用量的選擇
選定MnSO4用量為0.28g/L、0.84g/L、1.4g/L,pH值在12,曝氣量為120L/h,試驗水初始S2-濃度為500mg/L情況下,試驗結果見表2。
 |
2.3.4曝氣量的影響
理論上,每氧化1kgS2-成為SO42-需2kg氧,相當于6.7m3空氣。1kgS2-成為S2O32-需要1kg氧,相當于3.3m3空氣。1kgS2-成為S需0.5kg氧,相當于1.7m3空氣。
結合砂芯曝氣頭效率,以及S2-氧化理論所需氧量,采用介于將S2-氧化成S2O32-、SO42-所需氧量安排試驗。本試驗分別選取曝氣量60L/h、90L/h、120L/h,溫度為室溫,催化劑投量1.4g/L,試驗水初始S2-濃度為500mg/L情況下,試驗結果見表3。
 |
2.3.5pH值的影響
pH值對該反應有重要的影響,據資料報道,pH值愈小,廢水中的硫化物以H2S的形式釋出愈多,pH≤5時,廢水中的硫化物以H2S的形式可全部被吹脫出來;pH≥8.5時,被吹脫出的H2S僅占4%(摩爾分數)。在酸性溶液中,硫化物被氧化時各電對具有較弱的氧化能力:
 |
由此可見,硫化物的氧化以堿性條件較為適宜。
據資料顯示,pH值為10.5~13時,硫化物的氧化反應速度增長較快,pH值為11.5時,硫化物的氧化反應速度出現最大值,因此本研究中取pH值為12.0。
2.3.6溫度的影響
選定MnSO4用量為1.4g/L、曝氣量為120L/h,試驗水初始濃度為500mg/L,在溫度15℃、25℃、40℃、60℃測定S2-隨時間的變化情況。試驗結果見表4。
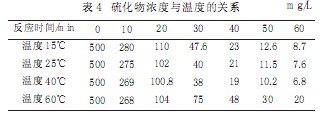 |
從試驗結果可以看出,溫度在15~40℃范圍內,硫化物的去除率變化不大。根據阿侖尼烏斯公式:反應溫度常數與溫度成指數關系,溫度升高使速率常數變化,促進反應加速進行,又依據氧傳遞速率公式,溫度升高使氧總傳遞速率變大,有利于提高氧的傳遞速率,加快硫化物的氧化速度,另一方面隨溫度的升高水中的溶解氧下降,降低了氧擴散動力,綜合考慮這些因素,在本次試驗中溫度在15~40℃范圍內進行催化氧化較為適宜。
2.3.7催化劑復用
選定MnSO4用量為1.4g/L,曝氣量為120L/h,試驗用水初始濃度為500mg/L,在室溫下,重復進行催化氧化試驗,每試驗完畢后,用漏斗將催化劑過濾,再用試驗用水洗入試驗裝置中,試驗結果見表5。
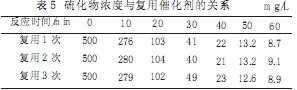 |
從試驗結果可以看出,催化劑重復使用情況下,對硫的去除率影響不大,因此催化劑可重復使用。
2.3.8催化劑沉降試驗
催化劑回收采用沉淀池,催化劑沉降試驗的目的是測得顆粒沉淀速度u0,為工程設計提供依據。分散性固體顆粒的沉降稱為自由沉淀。在其沉淀過程中,顆粒間互不凝聚,各自等速下沉,下沉過程中顆粒的物理性質不發生變化。在水深1.5m,直徑200mm的沉淀柱內,通過不同的沉淀時間測定不同的沉淀速度,通過確定的沉淀時間t0可以求得沉淀速度u0。
按MnSO41.4g/L投加量,用5%NaOH調節pH值為12,曝氣30min,形成含有棕黑色絮狀沉淀的懸浮液,在沉降柱內沉降試驗,測定催化劑的沉降速度。試驗結果見表6。
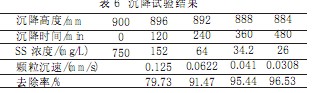 |
允許5%的催化劑的損失,因此選在去除率在95%時顆粒沉速為工程設計依據,即u0=0.05mm/s。
2.4模擬水樣實驗小結
通過對配制的模擬水樣的試驗研究得出如下
結論:催化劑選用MnSO4,投加量為1.4g/L,pH值為12,曝氣量采用介于將硫離子氧化成硫代硫酸鹽和硫酸鹽所需的理論空氣量,在室溫條件下催化氧化1h,出水可以達到≤10mg/L的要求。
3渤天無機鹽分廠水樣驗證試驗
根據實驗得出的結論,催化劑MnSO41.4g/L,pH值為12,曝氣量120L/h,催化氧化時間1h,室溫下對無機鹽分廠的三組水樣進行驗證,出水S2。來源:谷騰水網


