電鍍是利用電化學方法對金屬或非金屬材料的表面進行裝飾、防護以獲得某些新性能的一種工藝過程,具有通用性強、使用面廣的特點。電鍍過程會產生含重金屬離子、氰根離子的廢水以及酸堿廢水。各類電鍍廢水經過預處理后混合,即成為綜合電鍍廢水,成分非常復雜,對環境和人類健康危害大。綜合電鍍廢水中含有鎘(Ⅱ)、鋅(Ⅱ)、鎳(Ⅱ)、銅(Ⅱ)等對環境有害的重金屬離子,還含有各種絡合劑、表面活性劑等,如何針對廢水的成分特點,采取行之有效的工藝處理,使之穩定達到《電鍍污染物排放標準》(GB21900-2008),成為電鍍企業和科技工作者關注的熱點之一。在這方面比較有代表性的研究結果如下:鄧學文采用PAC、PFS以及硫酸鉀鋁等絮凝劑處理綜合電鍍廢水,以期克服傳統處理模式中單一絮凝劑效果不盡理想的缺點,整體處理工序較為簡易,成本低。不足之處在于鋅、銅等重金屬物質不能得到全面清除;崔洪升等針對某電鍍科技園的綜合電鍍廢水,采用漂水氧化破除絡合物并配合氫氧化物和硫化物共沉淀的方法進行處理,能夠較好地去除其中的金屬離子。該處理工藝藥劑材料來源廣泛,工藝運行費用較低,但流程較長;王月娟等針對電鍍廢水含有多種重金屬離子和氰化物的特點,采用微電解-破氰預處理-中和混凝反應等處理工藝進行處理,出水水質穩定,可直接排放,該法的缺點是設備投資較大。
鐵-碳微電解法是指以鐵屑作為微電解的原料,即當鐵屑浸沒在偏酸性的廢水溶液中時就會構成數以千計的微原電池(其中純鐵作為陽極,有雜質組成的碳化鐵為陰極),同時,由于碳顆粒的存在,鐵屑與碳顆粒之間彼此接觸,從而形成了宏觀原電池,在此系統中同時發生多種化學反應從而有效去除廢水中的污染物的方法。硫化物沉淀法是根據S2-與重金屬離子生成的硫化物沉淀較氫氧化物的溶解度更小的原理去除廢水中的重金屬(離子),是工程實踐中常用的重金屬廢水處理方法,具有較寬的pH使用范圍,因而應用廣泛。
本文嘗試將鐵-碳微電解與硫化鈉沉淀法組合,處理取自貴陽市某機械加工企業電鍍車間產生的綜合電鍍廢水,以期兼具氧化破絡、絮凝、沉淀之效,有效去除廢水中的多種重金屬離子,探討Fe/C摩爾比、Na2S投加量和廢水最終pH等工藝參數對重金屬離子去除率的影響。
1、實驗材料與方法
1.1 主要試劑、儀器及實驗廢水(綜合電鍍廢水)
鐵屑(貴陽市烏當區083基地電鍍廢水處理站,60目,Fe/C可以根據需要由供貨方調整)、氫氧化鈉(茂名市雄大化工有限公司深圳分公司)、濃硫酸(廣州德樹化工有限公司)、FeSO4·7H2O(天津市光復科技發展有限公司),Na2S·9H2O(無錫市晶科化工有限公司),以上試劑均為分析純。所用水為去離子水。
722分光光度計,上海菁華科技儀器有限公司;ST300型pH計(精密酸度計),上海雷磁儀器有限公司;DF-101SZ數顯轉速集熱式恒溫加熱磁力攪拌器,上海凌科實業發展有限公司。
電鍍廢水取自貴陽市烏當區083基地某電鍍車間的綜合電鍍廢水調節池。
1.2 實驗方法
用量筒量取250mL含有鎘(Ⅱ)、鋅(Ⅱ)、鎳(Ⅱ)、銅(Ⅱ)的綜合電鍍廢水于一系列400mL的燒杯中,在不同實驗條件(包括Fe/C摩爾比、九水硫化鈉投加量、廢水最終pH)下進行試驗。在攪拌下先加入不同Fe/C的鐵屑,先進行微電解反應,5min后再投加一定量的九水硫化鈉,以NaOH和H2SO4溶液調節廢水pH至指定值,繼續攪拌反應10min,然后靜置30min,使固液徹底分離,取上部清液測定其中殘余金屬離子的質量濃度。
1.3 分析方法
委托貴州大學化工及環境研究測試中心(采用ICP-AAS法)測定廢水及上清液中相關重金屬離子濃度,pH值自行測定,結果如表1。
去除率的定義: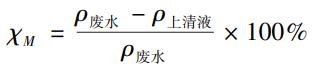
式中:χM—金屬離子的去除率,%;ρ廢水—廢水中金屬離子的質量濃度,mg/L;ρ上清液—上清液中殘余金屬離子的質量濃度,mg/L。
2、結果與討論
2.1 Fe/C摩爾比對殘余金屬離子濃度的影響
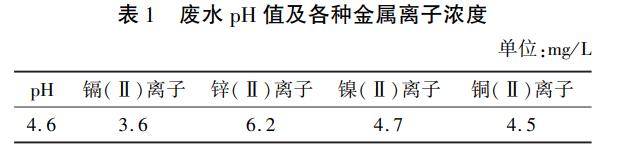
按照1.2的方法,在250mL廢水(pH4.6)中加入不同Fe/C的鐵屑5g,常溫下攪拌反應10min,靜置沉淀30min后取上清液進行檢測,得到各種金屬離子的質量濃度與Fe/C摩爾比的關系,如圖1所示。
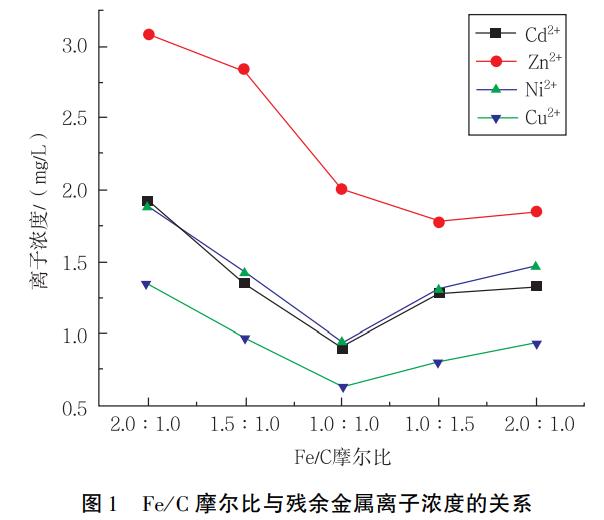
可見隨著Fe/C摩爾比的增大,上清液中殘余的金屬離子不斷減少。當Fe/C摩爾比為1:1.14時,金屬離子殘余質量濃度達到最小。在微電解過程中,微電池產生的Fe2+促使溶液中的重金屬離子產生氫氧化物沉淀而被從廢水中去除。但當Fe2+量過多時,與純鐵對應的碳化鐵陰極嚴重不匹配,導致系統中微電解反應受阻,重金屬離子的去除效果變差;而且過量的Fe2+極易被氧化成Fe3+,造成廢水色度增加。鑒于以上結果,本試驗選取的最佳Fe/C摩爾比為1:1.14。微電解過程可以去除廢水中65%以上鎘(Ⅱ)、鎳(Ⅱ)、銅(Ⅱ)離子,對鋅(Ⅱ)離子的去除率要小些,僅達46%。經過微電解工序處理后,廢水中重金屬離子的含量大幅降低,為后續硫化鈉沉淀法減少了負荷。
2.2 Na2S投加量對殘余金屬離子濃度的影響
按照1.2的方法,固定Fe/C摩爾比為1:1.14,在250mL廢水中加入不同量的Na2S·9H2O,常溫下攪拌反應5min,之后調節廢水pH至6.5,再反應10min,靜置沉淀30min后取上清液進行檢測,得到各種金屬離子的質量濃度與Na2S·9H2O投加量的關系,如圖2所示。
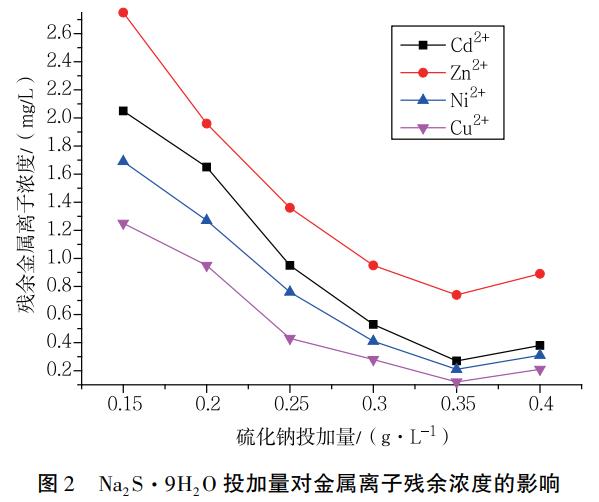
隨著Na2S·9H2O投加量的增加,上清液中金屬離子濃度減少。當Na2S·9H2O的投加量為0.29g/L時,上清液中金屬離子濃度最低,分別為Cd2+0.46mg/L、Zn2+1.35mg/L、Ni2+0.47mg/L、Cu2+0.29mg/L。在Fe/C摩爾比一定的情況下,Na2S·9H2O的投加量越大,反應產生的MS(硫化物沉淀)就越多。但當Na2S·9H2O投加量過大時,生成的MS會因形成多硫化物絡合物而溶解,導致上清液中金屬離子含量增加。所以Na2S·9H2O的投加量過低或過高都會影響金屬離子的去除效果。Na2S·9H2O的用量因廢水水質而異。在本實驗條件下,Na2S·9H2O的最佳投加量為0.29g/L。
2.3 最終pH值對殘余金屬離子濃度的影響
按照1.2的方法,固定Fe/C摩爾比為1:1.14、Na2S·9H2O投加量為0.29g/L的,用稀H2SO4或NaOH溶液調節廢水的最終pH,然后取適量上清液測試其中相關金屬離子的濃度,以金屬離子濃度對pH值作圖,如下圖3。

廢水的最終pH對廢水處理結果影響大。當pH=3時,處理后的廢水中鎘(Ⅱ)離子質量濃度為0.75mg/L、鋅離子(Ⅱ)質量濃度為1.65mg/L、鎳(Ⅱ)離子質量濃度為1.21mg/L、銅(Ⅱ)離子質量濃度為0.45mg/L。而當廢水最終pH=7時,處理后的廢水中鎘(Ⅱ)、鋅(Ⅱ)、鎳(Ⅱ)、銅(Ⅱ)幾種重金屬離子的質量濃度降至最低,分別為Cd2+0.35mg/L、Zn2+0.98mg/L、Ni2+0.27mg/L和Cu2+0.18mg/L。根據實驗結果,確定最終pH值為7.0。
3、結論
利用鐵-碳微電解-改進硫化鈉沉淀法處理綜合電鍍廢水,可同時去除廢水中多種重金屬離子,沉淀反應速度快。影響金屬離子去除率的主要因素是Fe/C摩爾比、Na2S投加量以及反應體系的最終pH。鐵-碳微電解步驟可以去除綜合電鍍廢水中半數以上重金屬離子,減輕后續硫化鈉沉淀法的處理負荷,降低廢水處理成本,確保廢水達標排放。
在最佳實驗條件下(Fe/C摩爾比為1:1.14,Na2S·9H2O投加量為0.29g/L,最終pH為7.0,常溫下攪拌反應15min),各種重金屬離子在上清液中的殘余質量濃度分別是鎘(Ⅱ)離子0.35mg/L、鋅(Ⅱ)離子0.98mg/L、鎳(Ⅱ)離子0.27mg/L、銅(Ⅱ)離子0.18mg/L,金屬離子的去除率分別是Cd2+90.3%、Zn2+84.2%、Ni2+94.3%和Cu2+96.0%,根據《電鍍污染物排放標準》(GB21900-2008)表2中Cd2+排放濃度限值是0.05mg/L,而經本方法處理,廢水中Cd2+的濃度是0.35mg/L,遠未達到要求,還需采用重金屬捕集劑或其他方法進一步去除廢水中殘余的Cd2+。(來源:貴州省環境科學研究設計院)



